Естар
Естри (нем. Essig-Äther, што је стари назив за етил-етаноат) органска су једињења која у својим молекулима садрже остатак молекула киселине и остатак молекула алкохола.[1] Естри дају мирис воћу, поврћу и четинарима. Њихова општа формула је: CnH2n+1-COO-CnH2n+1. У хемији, естар је функционална група изведена из киселине (органске или неорганске) у којој је атом водоника (Х) најмање једне киселе хидроксилне групе (−ОХ) те киселине замењен органском групом (Р′) . Аналоги добијени од кисеоника замењеног другим халкогенима такође припадају категорији естара.[2] Према неким ауторима, органски деривати киселог водоника других киселина су такође естри (нпр. амиди), али не према ИУПАЦ.[2]
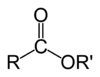

Естри добијају називе у зависности од тога који је алкохол и која киселина изреаговала. Ако је рецимо, реаговао етанол и етанска киселина, добија се естар који се назива етил-етаноат или етил-ацетат. Тај назив је изведен од етил-групе алкохола и назива соли етанске киселине. Соли етанске киселине се називају етаноати или ацетати.
- CH3-COOH + CH3-CH2-OH → CH3-COO-CH2-CH3 + H2O
Естри се добијају у реакцији естерификације. Та се реакција одвија у киселој средини. Супротна реакција естерификацији је хидролиза. У тој реакцији се добијена вода из естерификације једини са естром који је добијен и даје полазне супстанце: алкохол и киселину.
- CH3-COO-CH2-CH3 + H2O → CH3-COOH + CH3-CH2-OH
Естри се користе у прехрамбеној индустрији за производњу вештачких мириса, као растварачи боја, лакова и као сировина за добијање вештачких влакана. Један од најпознатијих естара је нитроглицерин, који се добија реакцијом тровалентног алкохола глицерола и азотне киселине, уз присуство сумпорне киселине.[3][4][5]
Глицериди су естри масних киселина и глицерола; они су важни у биологији, јер су једна од главних класа липида и чине већину животињских масти и биљних уља. Лактони су циклични карбоксилни естри; Природни лактони су углавном 5- и 6-члани лактони у прстену. Лактони доприносе ароми воћа, путера, сира, поврћа попут целера и друге хране.
Естри се могу формирати од оксокиселина (нпр. естри сирћетне киселине, угљене киселине, сумпорне киселине, фосфорне киселине, азотне киселине, ксантичне киселине), али и од киселина које не садрже кисеоник (нпр. естри тиоцијанске киселине и тритиокарбонске киселине). Пример формирања естра је реакција супституције између карбоксилне киселине (Р−Ц(=О)−ОХ) и алкохола (Р'−ОХ), формирајући естар (Р−Ц(=О)−О−Р'), где Р представља било коју групу (обично водоник или органил), а Р′ означава органил групу.
Органил естри карбоксилних киселина обично имају пријатан мирис; они мале молекуларне тежине се обично користе као мириси и налазе се у етеричним уљима и феромонима. Они делују као растварачи високог квалитета за широку лепезу пластике, пластификатора, смола и лакова,[6] и представљају једну од највећих класа синтетичких мазива на комерцијалном тржишту.[7] Полиестери су важне пластике, са мономерима повезаним естарским деловима. Естри фосфорне киселине чине кичму молекула ДНК. Естри азотне киселине, као што је нитроглицерин, познати су по својим експлозивним својствима.
Постоје једињења у којима кисели водоник киселина наведених у овом чланку није замењен органилом, већ неком другом групом. Према неким ауторима, та једињења су естри, посебно када је први атом угљеника органске групе која замењује кисели водоник, замењен другим атомом из групе 14 елемената (Си, Ге, Сн, Пб); на пример, према њима, триметилстанил ацетат (или триметилкалај ацетат) ЦХ
3ЦООСн(ЦХ
3)
3 је триметилстанил естар сирћетне киселине и дибутилкалај дилаурат (ЦХ
3(ЦХ
2)
10ЦОО)
2Сн((ЦХ
2)
3ЦХ
3)
2 је дибутилстаниленски естар лауринске киселине, а Филипсов катализатор ЦрО
2(ОСи(ОЦХ
3)
3)
2 је триметоксисилил естар хромне киселине (Х
2ЦрО
4).[8][9]
Именовање
уредиИменовање естера се базира на називу алкохола који је ступио у реакцију тј. прво иде назив алкилне скупине алкохола (нпр. назив алкилне скупине пропанола је пропил). Другим ријечима, умјесто уобичајеног завршетка -анол на основу имена алкохола дода се наставак -ил. Друга ријеч у називу естера потиче од киселине, а твори се тако да се имену киселине одузме наставак -ска и дода наставак -оат (нпр., друга ријеч у имену естера бутанске киселине била би бутаноат). Код естера са етанском киселином, често се умјесто етаноата употребљава: ацетат, код оних са метанском киселином: формијат, код естера са бутанском киселином: бутират, а код пропанске киселине: пропионат. Код алкохола такођер постоје други називи па се тако умјесто пентил, често нађе и амил: алкохол (-ол → -ил) + карбоксилне киселине (-ска → -оат)
Етимологија
уредиРеч естар је 1848. сковао немачки хемичар Леополд Гмелин,[10] вероватно као контракцију немачког Ессигäтхер, „сирћетни етар“.
ИУПАЦ-ова номенклатура
уредиЕстерска имена изведена су из назива матичног алкохола и родитељске киселине, где ова може бити органска или неорганска. Естри изведени из најједноставнијих карбоксилних киселина се обично зове према традицијским, такозваним тривијалним називима, нпр. као формат, ацетат, пропионат, и бутират, за разлику од ИУПАЦ-ове номенклатуре: метаноат, етаноат, пропаноат и бутаноат. Естри изведени из комплекснијих карбоксилних киселина су, с друге стране, чешће под називом који користи систематски назив по ИУПАЦ-у, на основу имена за киселину затим долази суфикс –оат. На пример, естер-хексилоктаноат, познат и под тривијалним именом хексил-каприлат, има формулу CH3(CH2)6CO2(CH2)5CH3.
Хемијске формуле органских естера обично имају облик RCO2R', где су R и R' делови угљиководика из карбоксилне киселине и алкохола. На пример, бутил ацетат (систематски бутил-етаноат), изведен из бутанола и ацетатне киселине (систематски етанска киселина) се пише као CH3CO2C4H9. Алтернативно приказивање обично укључује BuOAc и CH3COOC4H9. Циклични естри се зову лактони, без обзира на то да ли су изведени из органске или неорганске киселине. Један пример (органског) лактона је γ-валеролактон.
Ортоестри
уредиНеуобичајена класа органских естера су ортоестери, који имају формулу RC(OR′)3. Триетилортоформат (HC(OC2H5)3) је изведеница, у смислу имена (али не и синтезе) из ортомравље киселине (HC(OH)3) и етанола.
Неоргански естри
уредиЕстери могу такође да буду изведени из неорганских киселина и алкохола. Дакле, номенклатура се протеже на неорганске оксокиселине и њихове одговарајуће естре: фосфорна киселина и фосфатни естер/органофосфати, сумпорна киселина и сулфатни естер/органосулфати, азотна киселина и нитрат, борна киселина и борати. На пример, трифенил фосфат је естер изведен из фосфорне киселине и фенола. Органски карбонати су изведени из угљене киселине; на пример, етилен карбонат је изведен из угљене киселине и етилен гликола.
Алкохол и неорганска киселина повезивани су преко атома кисеоника. Дефиниција естера неорганске киселине који имају везу неорганских хемијских елемената између алкохола и неорганске киселине – везање атома фосфор и три алкокси функционалне групе у органофосфатима – може се проширити на исте елементе у разним комбинацијама ковалентне везе између угљеникових и централног неорганског атома и вези угљеник-кисеоник, са централним неоргански атомима. На пример, фосфорна својства три везе угљеник-кисеоник-фосфор и једну двоструку везу фосфор-кисеоник у органофосфатима, три везе угљеник–кисеоник–фосфор и ниједну двоструку везу фосфор–кисеоник у фосфитни естерима или органофосфитима, две везе угљеник–кисеоник–фосфор, ниједна фосфор–кисеоник двострука веза, али једна веза фосфор–угљеник у фосфонитима, једна веза угљеник–кисеоник–фосфор, ниједна двострука веза фосфор–кисеоник, али две везе фосфор–угљеник у фосфонитима.
Као последица, функције бора је стварање борних естара (n = 2), боронских естара (n = 1) и бората (n = 0). Кисеоник је хемијски елемент групе 16, а атоми сумпора могу заменити неке атоме кисеоника у угљеник–кисеоник централном неорганском атому ковалентних веза естера. Као резултат, стварају се тиосулфинати и тиосулфонати, са централнин неорганским атомом сумпора, јасно показујући асортиман сумпорних естера, који укључују и сулфатне, сулфитне, сулфонатне, сулфинатне и сулфенатне естере.
Естри се такође могу добити из неорганских киселина.
- Перхлорна киселина формира перхлоратне естре, на пример, метил перхлорат (ЦХ
3−О−Цл(=О)
3) - Сумпорна киселина формира сулфатне естре, на пример, диметил сулфат ((ЦХ
3−О−)
2С(=О)
2) и метил бисулфат (ЦХ
3−О−С(=О)
2−ОХ) - Азотна киселина формира нитратне естре, нпр. метил нитрат (ЦХ
3−О−НО
2) и нитроглицерин (ЦХ(−О−НО
2)(−ЦХ
2−О−НО
2)
2) - Фосфорна киселина формира фосфатне естре, нпр. трифенил фосфат (О=П(−О−Ц
6Х
5)
3) и [[[метхyл дихyдроген пхоспхате|метил дихидроген фосфат]] (О=П(−О−ЦХ
3)(−ОХ)
2)- Пирофосфорна (дифосфорна) киселина формира пирофосфатне естре, нпр. тетраетил пирофосфат, АДП, дАДП, АДПР, цАДПР, ЦДП, дЦДП, ГДП, дГДП, УДП, дТДП, МЕцПП, ХМБПП, ДМАПП, ИПП, ГПП, ФПП, ГГПП, ТхДП, ФАД, НАД, НАДП.
- Трифосфорна киселина формира трифосфатне естре, нпр. АТП, дАТП, ЦТП, дЦТП, ГТП, дГТП, УТП, дТТП, ИТП, XТП, ТхТП, АТхТП.
- Угљена киселина формира карбонатне естре, нпр. диметил карбонат ((ЦХ
3−О−)
2C=О) и петочлани циклични етилен карбонат ((−ЦХ
2−О−)
2C=О) (ако се угљена киселина класификује као неорганско једињење) - Тритиокарбонска киселина формира тритиокарбонатне естре, нпр. диметил тритиокарбонат ((ЦХ
3−С−)
2C=С) (ако се тритиокарбонска киселина класификује као неорганско једињење) - Хлоромравља киселина формира хлороформатне естре, нпр. метил хлороформијат (Цл−Ц(=О)−О−ЦХ
3) (ако се хлоромравља киселина класификује као неорганско једињење) - Борна киселина формира боратне естре, нпр. триметил борат (Б(−О−ЦХ
3)
3) - Хромна киселина формира ди-терц-бутил хромат (((ЦХ
3)
3Ц−О−)
2Цр(=О)
2)
Неорганске киселине које постоје као таутомери формирају две или више врста естара.
- Тиосумпорна киселина формира две врсте тиосулфатних естара, нпр. О,О-диметил тиосулфат ((ЦХ
3−О−)
2С(=О)(=С)) и О,С-диметил тиосулфат ((ЦХ
3−О−)(ЦХ
3−С−)С(=О)
2) - Тиоцијанска киселина формира тиоцијанатне естре, нпр. метил тиоцијанат (ЦХ
3−С−Ц≡Н) (ако се тиоцијанска киселина класификује као неорганско једињење), али формира и изотиоцијанатне „естре“, нпр. метил изотиоцијанат (ЦХ
3−Н=C=С), иако ИУПАЦ не класификује органил изотиоцијанате као естре - Фосфорна киселина формира две врсте естара: фосфитне естре, нпр. триетил фосфит (П(−О−ЦХ
2ЦХ
3)
3), и фосфонатне естре, нпр. диетил фосфонат (Х−П(=О)(−О−ЦХ
2ЦХ
3)
2)
Неке неорганске киселине које су нестабилне или неухватљиве формирају стабилне естре.
- Сумпорна киселина, која је нестабилна, формира стабилан диметил сулфит ((ЦХ
3−О−)
2С=О) - Дикарбонска киселина, која је нестабилна, формира стабилан диметил дикарбонат (ЦХ
3−О−Ц(=О)−О−Ц(=О)−О−ЦХ
3)
У принципу, део металних и металоидних алкоксида, којих је познато на стотине, могао би се класификовати као естри одговарајућих киселина (нпр. алуминијум триетоксид (Ал(ОЦХ
2ЦХ
3)
3 може се класификовати као естар алуминијумске киселине који је алуминијум хидроксид, тетраетил ортосиликат (Си(ОЦХ
2ЦХ
3)
4) може се класификовати као естар ортосилицијумске киселине и титанијум етоксид (Ти(ОЦХ
2ЦХ
3)
4) може се класификовати као естар ортотитанске киселине).
Структура и везивање
уредиЕстри садрже карбонилни центар, који има структурне мотиве C-C-O и O-C-O са угловима између веза од 120°. За разлику од амида, естри су структурно флексибилне функционалне групе јер ротација око C-O-C веза има ниску баријеру. Њихова флексибилност и ниска поларност се манифестује у њиховим физичким особинама. Они су мање ригидни (имају нижу тачку топљења) и испарљивији су (нижа тачка кључања) од одговарајућих амида.[12] pKa вредности алфа-водоника естера је око 25.[13]
Многи естри карбоксилне киселине имају потенцијал за конформациони изомеризам, али имају тенденцију да поприме С-цис (или З) конформацију пре него С-транс (или Е) алтернативу, због комбинације ефеката хиперкоњугације и минимизације дипола. На преференцију З конформације утиче природа супституената и растварача, ако је присутан.[14][15] Лактони са малим прстеновима су ограничени на с-транс (тј. Е) конформацију због своје цикличне структуре.
Физичка својства и карактеризација
уредиЕстри добијени од карбоксилних киселина и алкохола су поларнији од етара, али мање поларни од алкохола. Они учествују у водоничним везама као акцептори водоничне везе, али не могу деловати као донори водоничне везе, за разлику од својих матичних алкохола. Ова способност да учествују у везивању водоника даје извесну растворљивост у води. Због недостатка способности донирања водоничне везе, естри се не повезују сами. Сходно томе, естри су испарљивији од карбоксилних киселина сличне молекулске тежине.[12]
Карактеризација и анализа
уредиЕстри се генерално идентификују гасном хроматографијом, користећи предност њихове испарљивости. ИР спектри за естре карактеришу интензивну оштру траку у опсегу 1730–1750 цм−1 која је додељена νC=О. Овај пик се мења у зависности од функционалних група везаних за карбонил. На пример, бензенски прстен или двострука веза у спрези са карбонилом ће смањити таласни број за око 30 цм−1.
Триацилглицерол
уредиТриацилглицероли (масти и уља) су естри који садрже три хидроксилне групе. Именују се слично као и соли. Нерастворни су или слабо растворни у води (липиди).
Естри се могу добити реакцијом, обично органских, киселина и алкохола, уз каталитско присуство сумпорне киселине, иако има и других начина добијања естера. Естерификација је реверзибилна реакција у којој се истовремено догађа и хидролиза, па је потребно хигроскопно средство које реакцији одузима воду.
- Алкохоли + карбоксилне киселине ↔ естер + вода (естерификација)
- Естер + вода ↔ алкохоли + карбоксилне киселине (хидролиза)
Многи естри имају специфичан мирис, због чега се често користе као вештачке ароме и у производњи мириса. На пример:
Метил формијат
уредиМетил метаноат је безбојна течност карактеристичног етерског мириса, лако испарива, са малим површинским напоном.
- C2H4O2O=COC
Етил ацетат / етил етаноат
уредиОво је безбојна, лако запаљива течност карактеристичног мириса, попут лепка или средстава за скидање лака за нокте (C4H8O2, CC(=O)OCC или CH3COOCH2CH3). Етил ацетат је запаљив и кожни иритант.
Употреба
уредиЕстри се између осталог користе:
- као отров за убијање инсеката (за препарирање у ентомологији: инсект се убије, али се не уништи)
- у лепковима и одстрањивачима лака за нокте
- као реагенс за одређивање ангиотензин конвертирајућег ензима (АЦЕ)
Естри се обично употребљавају у прехрамбеној и кондиторској индустрији, производњи растварача и пластичних маса, и производњу парфема. Употребљава се и као инсектицид и у производњи неких лекова.
Естри су распрострањени у природи и широко се користе у индустрији. У природи, масти су, генерално, триестри добијени од глицерола и масних киселина.[16] Естри су одговорни за арому многих воћа, укључујући јабуке, дуријане, крушке, банане, ананас и јагоде.[17] Годишње се индустријски производи неколико милијарди килограма полиестера, а важни производи су полиетилен терефталат,[18] акрилатни естри[19] и ацетат целулозе.[20]
Добијање естера
уредиЕстери се добијају при синтези сирћетне киселине и етанола, уз присуство јаких киселина као што је сумпорна киселина.
- CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
Добијају се:
- естерификацијом метанола и етаноата: HCOOH + CH3OH → HCOOCH3 + H2O
- индустријски комбинацијом метанола и угљен моноксида: CH3OH + CO → HCOOCH3.
Естерификација је општи назив за хемијску реакцију у којој два реактанта (обично алкохол и киселина) формирају естар као производ реакције. Естри су уобичајени у органској хемији и биолошким материјалима и често имају пријатан карактеристичан, воћни мирис. То доводи до њихове широке употребе у индустрији мириса и укуса. Естарске везе се такође налазе у многим полимерима.
Естерификација карбоксилних киселина алкохолима
уредиКласична синтеза је Фишерова естерификација, која укључује третирање карбоксилне киселине алкохолом у присуству агенса за дехидратацију:
- РЦО
2Х + Р'ОХ ⇌ РЦО
2Р' + Х
2О
Константа равнотеже за такве реакције је око 5 за типичне естре, на пример, етил ацетат.[21] Реакција је спора у одсуству катализатора. Сумпорна киселина је типичан катализатор ове реакције. Користе се и многе друге киселине као што су полимерне сулфонске киселине. Пошто је естерификација веома реверзибилна, принос естра се може побољшати коришћењем Ле Шатељеовог принципа:[22][23][24][25][26]
- Коришћење алкохола у великом вишку (тј. као растварача).
- Коришћење средства за дехидратацију: сумпорна киселина не само да катализује реакцију, већ секвестрира воду (производ реакције). Друга средства за сушење као што су молекуларна сита[27][28][29] су такође ефикасна.
- Уклањање воде физичким средствима као што је дестилација као азеотроп ниске тачке кључања са толуеном, у комбинацији са Деан-Старковим апаратом.[30][31][32][33]
Познати су реагенси који покрећу дехидратацију смеша алкохола и карбоксилних киселина. Један пример је Стеглихова естерификација, која је метода формирања естара под благим условима.[34][35][36] Метода је популарна у синтези пептида, где су супстрати осетљиви на оштре услове попут високе топлоте. DCC (дициклохексилкарбодиимид) се користи за активирање карбоксилне киселине за даљу реакцију. 4-Диметиламинопиридин (ДМАП) се користи као катализатор ацил-трансфера.[37]
Друга метода за дехидратацију смеша алкохола и карбоксилних киселина је Мицунобуова реакција:[38][39][40][41][42][43][44]
- РЦО
2Х + Р'ОХ + П(C
6Х
5)
3 + Р
2Н
2 → РЦО
2Р' + ОП(C
6Х
5)
3 + Р
2Н
2Х
2
Карбоксилне киселине могу бити естерификоване помоћу диазометана:
- РЦО
2Х + ЦХ
2Н
2 → РЦО
2ЦХ
3 + Н
2
Коришћењем диазометана, смеше карбоксилних киселина могу се конвертовати у њихове метил естре у скоро квантитативним приносима, на пример, за анализу гасном хроматографијом. Метода је корисна у специјализованим органско синтетичким операцијама, али се сматра превише опасном и скупом за примене у великим размерама.
Естерификација карбоксилних киселина епоксидима
уредиКарбоксилне киселине се естерификују третманом са епоксидима, дајући β-хидроксиестре:
- РЦО
2Х + РЦХЦХ
2О → РЦО
2ЦХ
2ЦХ(ОХ)Р
Ова реакција се користи у производњи винил естарске смоле од акрилне киселине.
Алкохолиза ацилхлорида и анхидрида киселина
уредиАлкохоли реагују са ацил хлоридима и анхидридима киселина дајући естре:
- РЦОЦл + Р'ОХ → РЦО
2Р' + ХЦл - (РЦО)
2О + Р'ОХ → РЦО
2Р' + РЦО
2Х
Реакције су неповратне и поједностављују обраду. Пошто ацил хлориди и анхидриди киселина такође реагују са водом, пожељни су анхидровани услови. Аналогне ацилације амина које дају амиде су мање осетљиве јер су амини јачи нуклеофили и реагују брже од воде. Ова метода се користи само за лабораторијске процедуре, јер је скупа.
Алкилација карбоксилних киселина и њихових соли
уредиТриметилоксонијум тетрафлуороборат се може користити за естерификацију карбоксилних киселина под условима где су реакције катализоване киселином неизводљиве:[45]
- РЦО
2Х + (ЦХ
3)
3ОБФ
4 → РЦО
2ЦХ
3 + (ЦХ
3)
2О + ХБФ
4
Иако се ретко користе за естерификације, карбоксилатне соли (често створене ин ситу) реагују са електрофилним алкилационим агенсима, као што су алкил халогениди, дајући естре.[20][46] Доступност ањона може инхибирати ову реакцију, што сходно томе поспешено катализаторима фазног трансфера[47][48][49] или таквих високо поларних апротичних растварача као што је ДМФ. Додатна јодидна со може, преко Финкелштајнове реакције,[50][51][52][53][54] да катализује реакцију непослушног алкил халида. Алтернативно, соли координационог метала, као што је сребро, могу побољшати брзину реакције олакшавањем елиминације халогенида.
Трансестерификација
уредиТрансестерификација,[55][56] која укључује промену једног естра у други, широко се практикује:
- РЦО
2Р' + ЦХ
3ОХ → РЦО
2ЦХ
3 + Р'ОХ
Као и хидролиза, трансестерификација је катализована киселинама и базама. Реакција се широко користи за разградњу триглицерида, нпр. у производњи естара масних киселина и алкохола. Поли(етилен терефталат) се производи трансетерификацијом диметил терефталата и етилен гликола:[20]
- н (C
6Х
4)(ЦО
2ЦХ
3)
2 + 2н C
2Х
4(ОХ)
2 → [(C
6Х
4)(ЦО
2)
2(C
2Х
4)]
н + 2н ЦХ
3ОХ
Подскуп трансестерификације је алкохолиза дикетена. Ова реакција даје 2-кетоестре.[20]
- (ЦХ
2ЦО)
2 + РОХ → ЦХ
3C(О)ЦХ
2ЦО
2Р
Карбонилација
уредиАлкени се подвргавају карбоалкоксилацији[57][58][59] у присуству металних карбонилних катализатора. Естри пропионске киселине се комерцијално производе овом методом:
- Х
2C=ЦХ
2 + РОХ + ЦО → ЦХ
3ЦХ
2ЦО
2Р
Припрема метил пропионата је један илустративан пример.
- Х
2C=ЦХ
2 + ЦО + ЦХ
3ОХ → ЦХ
3ЦХ
2ЦО
2ЦХ
3
Карбонилација метанола даје метил формат, који је главни комерцијални извор мравље киселине. Реакција је катализована натријум метоксидом:
- ЦХ
3ОХ + ЦО → ХЦО
2ЦХ
3
Додавање карбоксилних киселина алкенима и алкинима
уредиУ хидроестерификацији, алкени и алкини се умећу у О−Х везу карбоксилних киселина. Винил ацетат се индустријски производи додавањем сирћетне киселине ацетилену у присуству катализатора цинк ацетата:[60]
- ХЦ≡ЦХ + ЦХ
3ЦО
2Х → ЦХ
3ЦО
2ЦХ=ЦХ
2
Винил ацетат се такође може произвести реакцијом етилена, сирћетне киселине и кисеоника катализованом паладијумом:
- 2 Х
2C=ЦХ
2 + 2 ЦХ
3ЦО
2Х + О
2 → 2 ЦХ
3ЦО
2ЦХ=ЦХ
2 + 2 Х
2О
Силиковолфрамска киселина се користи за производњу етил ацетата алкилацијом сирћетне киселине етиленом:
- Х
2C=ЦХ
2 + ЦХ
3ЦО
2Х → ЦХ
3ЦО
2ЦХ
2ЦХ
3
Из алдехида
уредиТишченкова реакција[61][62][63][64] укључује диспропорционисање алдехида у присуству анхидроване базе да би се добио естар. Катализатори су алуминијум алкоксиди или натријум алкоксиди. Бензалдехид реагује са натријум бензилоксидом (генерисаним од натријума и бензил алкохола) да би се добио бензил бензоат.[64] Метода се користи у производњи етил ацетата из ацеталдехида.[20]
Друге методе
уреди- Фаворскијево преуређење α-халокетона у присуству базе[65][66][67][68][69]
- Бејер-Вилигерова оксидација кетона са пероксидима[70][71][72]
- Пинерова реакција[73][74][75][76][77][78][79] нитрила са алкохолом
- Нуклеофилна апстракција метал–ацил комплекса[80][81]
- Хидролиза ортоестара у воденој киселини
- Целулолиза путем естерификације[82]
- Озонолиза[83][84][85] алкена коришћењем обраде у присуству хлороводоничне киселине и разних алкохола.[86]
- Анодна оксидација[87][88][89][90] метил кетона доводи до метил естара.[91]
- Интерестерификација размењује групе масних киселина различитих естара.[92][93][94][95][96][97]
Реакције
уредиЕстри су мање реактивни од киселих халогенида и анхидрида. Као и код реактивнијих ацил деривата, они могу да реагују са амонијаком и примарним и секундарним аминима дајући амиде, иако се ова врста реакције не користи често, пошто кисели халогениди дају боље приносе.
Трансестерификација
уредиЕстри се могу конвертовати у друге естре у процесу познатом као трансестерификација. Трансестерификација може бити катализована киселином или базом и обухвата реакцију естра са алкохолом. Пошто је одлазећа група такође алкохол, реакција унапред и уназад ће се често одвијати сличном брзином. Коришћење великог вишка реактантног алкохола или уклањање алкохола одлазеће групе (нпр. дестилацијом) потиснуће реакцију напред ка завршетку, у складу са Ле Шатељеовим принципом.[98]
Хидролиза и сапонификација
уредиХидролиза естара катализована киселином је такође равнотежни процес – у суштини реверзан реакцији Фишерове естерификације.[99][100][101][102][103] Пошто алкохол (који делује као одлазећа група) и вода (која делује као нуклеофил) имају сличне пКа вредности, директна и реверзна реакција се такмиче једна са другом. Као и код трансестерификације, коришћење великог вишка реактанта (воде) или уклањање једног од производа (алкохола) може подстаћи реакцију унапред.
Базна хидролиза естара, позната као сапонификација, није равнотежни процес; пун еквивалент базе се троши у реакцији, при чему се производи један еквивалент алкохола и један еквивалент карбоксилатне соли. Сапонификација естара масних киселина је индустријски важан процес, који се користи у производњи сапуна.[98]
Естерификација је реверзибилна реакција. Естри се подвргавају хидролизи у киселим и базним условима. У киселим условима, реакција је реверзна реакција Фишерове естерификације. У базним условима, хидроксид делује као нуклеофил, док је алкоксид одлазећа група. Ова реакција, сапонификација, је основа за прављење сапуна.
Алкоксидна група такође може бити замењена јачим нуклеофилима као што су амонијак или примарни или секундарни амини да би се добили амиди (реакција амонолизе):
- РЦО
2Р' + НХ
2Р″ → РЦОНХР″ + Р'ОХ
Ова реакција обично није реверзибилна. Уместо амина могу се користити хидразини и хидроксиламин. Естри се могу конвертовати у изоцијанате преко интермедијарних хидроксаминских киселина[104][105] у Лосеновом преуређењу.[106][107][108][109][110]
Извори угљеникових нуклеофила, на пример, Григнардови реагенси[111][112][113] и органолитијумова једињења, лако се додају карбонилу.
Редукција
уредиУ поређењу са кетонима и алдехидима, естри су релативно отпорни на редукцију. Увођење каталитичке хидрогенације у раном делу 20. века представљао је пробој; естри масних киселина се хидрогенишу у масне алкохоле.
- РЦО
2Р' + 2 Х
2 → РЦХ
2ОХ + Р'ОХ
Типичан катализатор је бакар хромит. Пре развоја каталитичке хидрогенације, естри су редуковани у великој мери коришћењем Буво-Бланкове редукције.[114][115][116][117][118][119][120][121] Овај метод, који је у великој мери застарео, користи натријум у присуству извора протона.
Посебно за фине хемијске синтезе, литијум алуминијум хидрид се користи за редукцију естара на два примарна алкохола. Повезани реагенс натријум борохидрид је спор у овој реакцији. ДИБАХ редукује естре у алдехиде.[122]
Директна редукција да би се добио одговарајући етар је тешка јер средишњи хемиацетал има тенденцију да се разгради дајући алкохол и алдехид (који брзо редукује да би се добио други алкохол). Реакција се може постићи коришћењем триетилсилана са разним Луисовим киселинама.[123][124]
Клајзенова кондензација и сродне реакције
уредиЕстри могу бити подвргнути разним реакцијама са нуклеофилима угљеника. Реагују са вишком Григнардовог реагенса дајући терцијарне алкохоле. Естри такође лако реагују са енолатима. У Клајзеновој кондензацији,[125][126][127][128][129] енолат једног естра (1) ће напасти карбонилну групу другог естра (2) да би дао тетраедарски интермедијер 3. Интермедијер се колапсира, истискујући алкоксид (Р'О−) и стварајући β-кето естар 4.
Могуће су и укрштене Клајзеновове кондензације, у којима су енолат и нуклеофил различити естри. Интрамолекуларна Клајзеновова кондензација се зове Дикманова кондензација[130][131][132] или Дикманова циклизација, јер се може користити за формирање прстенова. Естри се такође могу подвргнути кондензацији са кетонским и алдехид енолатима да би се добила β-дикарбонилна једињења.[133] Специфичан пример овога је Бејкер-Венкатараманово преуређење,[134][135][136][137][138][139][140][141][142][143][144] у коме ароматични орто-ацилокси кетон пролази кроз интрамолекуларну нуклеофилну ацил супституцију и накнадно преуређење да би се формирао ароматични β-дикетон.[145] Чаново преуређење[146][147] је још један пример преуређења који је резултат реакције интрамолекуларне нуклеофилне ацил супституције.
Друге естарске реактивности
уредиЕстри реагују са нуклеофилима на карбонилном угљенику. Карбонил је слабо електрофилан, али га нападају јаки нуклеофили (амини, алкоксиди, извори хидрида, органолитијумова једињења, итд.). Ц–Х везе суседне карбонилу су слабо киселе, али подлежу депротонацији јаким базама. Овај процес је онај који обично покреће реакције кондензације. Карбонил кисеоник у естрима је слабо базичан, мање од карбонилног кисеоника у амидима због резонантне донације електронског пара из азота у амидима, али формира адукте.
Што се тиче алдехида, атоми водоника на суседном угљенику (у „α позицији“) карбоксилној групи у естрима су довољно кисели да подлежу депротонацији, што заузврат доводи до разних корисних реакција. Депротонација захтева релативно јаке базе, као што су алкоксиди. Депротонација даје нуклеофилни енолат, који може даље да реагује, на пример, Клајазеновом кондензацијом и њеним интрамолекуларним еквивалентом, Дикмановом кондензацијом. Ова конверзија се користи у синтези естра малонске киселине,[148][149] при чему диестар малонске киселине реагује са електрофилом (нпр. алкил халидом), а затим се декарбоксилира. Друга варијација је Фратер-Себахова алкилација.[150][151][152][153][154]
Друге реакције
уреди- Естри се могу директно претворити у нитриле.[155]
- Метил естри су често подложни декарбоксилацији у Крапчовој декарбоксилацији.[156][157][158][159][160]
- Фенил естри реагују на хидроксиарилкетоне у Фрајесовом реаранжману.[161][162][163][164]
- Специфични естри су функционализовани са α-хидроксилном групом у Чановом реаранжману.
- Естри са β-атомима водоника могу се конвертовати у алкене у естарској пиролизи.[165][166][167]
- Парови естара су спојени да дају α-хидроксикетоне у ацилоинској кондензацији.[168][169][170]
Заштитне групе
уредиКао класа, естри служе као заштитне групе[171][172] за карбоксилне киселине. Заштита карбоксилне киселине је корисна у синтези пептида, да би се спречиле самосталне реакције бифункционалних аминокиселина. Метил и етил естри су обично доступни за многе аминокиселине; т-бутил естар има тенденцију да буде скупљи. Међутим, т-бутил естри су посебно корисни јер, под јако киселим условима, т-бутил естри се подвргавају елиминацији дајући карбоксилну киселину и изобутилен, што поједностављује обраду.
Естерски мириси
уредиРеференце
уреди- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ а б ИУПАЦ. „естерс”. Компендијум хемијске терминологије (Интернет издање).
- ^ Хунтер Г. К. (2000): Витал Форцес. Тхе дисцоверy оф тхе молецулар басис оф лифе. . London: Academic Press. 2000. ISBN 978-0-12-361811-5.
- ^ Нелсон D. L., Цоx M. M. (2013): Лехнингер Принциплес оф Биоцхемистрy. . W. H. Freeman and Co. ISBN 978-1-4641-0962-1.
- ^ Халл Ј. Е., Гуyтон А. C. (2006): Теxтбоок оф медицал пхyсиологy, 11тх едитион. Елсевиер Саундерс, Ст. Лоуис, Мо. ISBN 978-0-7216-0240-0.
- ^ Cameron Wright (1986). A worker's guide to solvent hazards. The Group. стр. 48. ISBN 9780969054542.
- ^ E. Richard Booser (21. 12. 1993). CRC Handbook of Lubrication and Tribology, Volume III: Monitoring, Materials, Synthetic Lubricants, and Applications. CRC. стр. 237. ISBN 978-1-4200-5045-5.
- ^ „Acetoxytrimethyltin”.
- ^ „Trimethyltin acetate | C5H12O2Sn | ChemSpider”.
- ^ Leopold Gmelin (1848). Handbuch der Chemie, vol. 4: Handbuch der organischen Chemie. стр. 182.. (vol. 1) (Heidelberg, Baden. (Germany): Karl Winter), [1].
Original text:
Translation:b. Ester oder sauerstoffsäure Aetherarten.
Ethers du troisième genre.
Viele mineralische und organische Sauerstoffsäuren treten mit einer Alkohol-Art unter Ausscheidung von Wasser zu neutralen flüchtigen ätherischen Verbindungen zusammen, welche man als gepaarte Verbindungen von Alkohol und Säuren-Wasser oder, nach der Radicaltheorie, als Salze betrachten kann, in welchen eine Säure mit einem Aether verbunden ist.b. Ester or oxy-acid ethers.
Ethers of the third type.
Many mineral and organic acids containing oxygen combine with an alcohol upon elimination of water to [form] neutral, volatile ether compounds, which one can view as coupled compounds of alcohol and acid-water, or, according to the theory of radicals, as salts in which an acid is bonded with an ether. - ^ A. A. Yakovenko; J. H. Gallegos; M. Yu. Antipin; A. Masunov; T. V. Timofeeva (2011). „Crystal Morphology as an Evidence of Supramolecular Organization in Adducts of 1,2-Bis(chloromercurio)tetrafluorobenzene with Organic Esters”. Crystal Growth & Design. 11 (9): 3964—3978. doi:10.1021/cg200547k.
- ^ а б Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ „Chemistry of Enols and Enolates - Acidity of alpha-hydrogens”. Архивирано из оригинала 07. 01. 2018. г. Приступљено 25. 11. 2011.
- ^ Диwакар M. Паwар; Абделнасер А. Кхалил; Денисе Р. Хоокс; Кеннетх Цоллинс; Тијуана Еллиотт; Јеффореy Стаффорд; Луцилле Смитх; Ериц А. Ное (1998). „Е анд З Цонформатионс оф Естерс, Тхиол Естерс, анд Амидес”. Јоурнал оф тхе Америцан Цхемицал Социетy. 120 (9): 2108—2112. дои:10.1021/ја9723848.
- ^ Цхристопхе Дугаве; Луц Деманге (2003). „Цис−Транс Исомеризатион оф Органиц Молецулес анд Биомолецулес: Имплицатионс анд Апплицатионс”. Цхемицал Ревиеwс. 103 (7): 2475—2932. ПМИД 12848578. дои:10.1021/цр0104375.
- ^ Исолатион оф триглyцериде фром нутмег: Г. D. Беал "Тримyристен" Органиц Сyнтхесес, Цолл. Вол. 1. п (ПДФ). 538 (1941) http://orgsynth.org/orgsyn/pdfs/CV1P0538.pdf. Недостаје или је празан параметар
|title=(помоћ) - ^ McGee, Harold. On Food and Cooking. 2003, Scribner, New York.
- ^ De Vos, Lobke; Van de Voorde, Babs; Van Daele, Lenny; Dubruel, Peter; Van Vlierberghe, Sandra (децембар 2021). „Poly(alkylene terephthalate)s: From current developments in synthetic strategies towards applications”. European Polymer Journal. 161: 110840. Bibcode:2021EurPJ.16110840D. doi:10.1016/j.eurpolymj.2021.110840. hdl:1854/LU-8730084 .
- ^ Takashi Ohara; Takahisa Sato; Noboru Shimizu; Günter Prescher; Helmut Schwind; Otto Weiberg; Klaus Marten; Helmut Greim (2003). „Acrylic Acid and Derivatives”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a01_161.pub2.
- ^ а б в г д „Esters, Organic”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. doi:10.1002/14356007.a09_565.pub2.
- ^ Williams, Roger J.; Gabriel, Alton; Andrews, Roy C. (1928). „The Relation Between the Hydrolysis Equilibrium Constant of Esters and the Strengths of the Corresponding Acids”. Journal of the American Chemical Society. 50 (5): 1267—1271. doi:10.1021/ja01392a005.
- ^ Helmenstine, Anne Marie (2020). „Le Chatelier's Principle Definition”. ThoughtCo. Архивирано из оригинала 2021-04-20. г. Приступљено 2022-03-09.
- ^ Ball, David W.; Key, Jessie A. (2014-09-16). „Shifting Equilibria: Le Chatelier’s Principle”. Introductory Chemistry – 1st Canadian edition (на језику: енглески). Victoria, B.C: BCcampus: OpenEd. ISBN 978-1-77420-003-2 — преко opentextbc.ca.
- ^ Mander, Peter (2016-09-01). „Le Châtelier's principle”. carnotcycle (на језику: енглески). Приступљено 2024-09-29.
- ^ fr:s:Page:Comptes rendus hebdomadaires des séances de l’Académie des sciences, tome 099, 1884.djvu/786
- ^ Kheilová, M.; Štrunc, M. (1995). „Is the Le Chatelier-Braun Principle Valid in General in Linear Nonequilibrium Thermodynamics?”. Journal of Non-Equilibrium Thermodynamics (на језику: енглески). 1995-01-01 (1): 19—38. ISSN 1437-4358. doi:10.1515/jnet.1995.20.1.19.
- ^ Kresge, Charles T.; Dhingra, Sandeep S. (2004). „Molecular Sieves”. Kirk-Othmer Encyclopedia of Chemical Technology. ISBN 978-0-471-48494-3. doi:10.1002/0471238961.1315120511210812.a01.pub2.
- ^ Mazur, Michal; Přech, Jan; Čejka, Jiří (2019). „Zeolites and Other Micro- and Mesoporous Molecular Sieves”. Kirk-Othmer Encyclopedia of Chemical Technology. стр. 1—36. ISBN 978-0-471-48494-3. doi:10.1002/0471238961.zeolcejk.a01.pub2.
- ^ Cohen, Alan P. (2003). „Desiccants”. Kirk-Othmer Encyclopedia of Chemical Technology. ISBN 978-0-471-48494-3. doi:10.1002/0471238961.0405190903150805.a01.pub2.
- ^ „Dean–Stark Apparatus”. University of Southampton, University of Birmingham, University of Nottingham and University of Sheffield. Архивирано из оригинала 8. 9. 2011. г. Приступљено 17. 11. 2011.
- ^ Wiberg, Kenneth B. (1960). Laboratory Technique in Organic Chemistry. McGraw-Hill series in advanced chemistry. New York: McGraw Hill. ASIN B0007ENAMY.
- ^ E. W. Dean and D. D. Stark (1920). „A convenient method for the determination of water in petroleum and other organic emulsions”. The Journal of Industrial & Engineering Chemistry. 12 (5): 486—490. doi:10.1021/ie50125a025.
- ^ Andrea Sella (јун 2010). „Classic kit: Dean–Stark apparatus”. Chemistry World. Royal Society of Chemistry.
- ^ B. Neises, W. Steglich (1978). „Simple Method for the Esterification of Carboxylic Acids”. Angew. Chem. Int. Ed. 17 (7): 522—524. doi:10.1002/anie.197805221.
- ^ J. C. Sheehan, G. P. Hess (1955). „A New Method of Forming Peptide Bonds”. J. Am. Chem. Soc. 77 (4): 1067—1068. doi:10.1021/ja01609a099.
- ^ W. König, R. Geiger (1970). „Eine neue Methode zur Synthese von Peptiden: Aktivierung der Carboxylgruppe mit Dicyclohexylcarbodiimid unter Zusatz von 1-Hydroxy-benzotriazolen”. Chem. Ber. 103 (3): 788—798. PMID 5436656. doi:10.1002/cber.19701030319.
- ^ B. Neises; W. Steglich. „Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: tert-Butyl ethyl fumarate”. Org. Synth.; Coll. Vol., 7, стр. 93
- ^ Mitsunobu, O.; Yamada, Y. (1967). „Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts”. Bulletin of the Chemical Society of Japan. 40 (10): 2380—2382. doi:10.1246/bcsj.40.2380.
- ^ „Organic Syntheses Procedure”. orgsyn.org (на језику: енглески). Приступљено 2023-02-13.
- ^ Mitsunobu, O. (1981). „The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products”. Synthesis. 1981 (1): 1—28. doi:10.1055/s-1981-29317.
- ^ Castro, B. R. (1983). „Replacement of Alcoholic Hydroxyl Groups by Halogens and Other Nucleophiles via Oxyphosphonium Intermediates”. Replacement of Alcoholic Hydroxy Groups by Halogens and Other Nucleophiles via Oxyphosphonium Intermediates. Organic Reactions. 29. стр. 1—162. ISBN 9780471264187. doi:10.1002/0471264180.or029.01.
- ^ Hughes, D. L. (1992). „The Mitsunobu Reaction”. Organic Reactions. 42. стр. 335—656. ISBN 9780471264187. doi:10.1002/0471264180.or042.02.
- ^ Hughes, D. L. (1996). „Progress in the Mitsunobu Reaction. A Review”. Organic Preparations and Procedures International. 28 (2): 127—164. doi:10.1080/00304949609356516.
- ^ Swamy, K. C. K.; Kumar, N. N. B.; Balaraman, E.; Kumar, K. V. P. P. (2009). „Mitsunobu and Related Reactions: Advances and Applications”. Chemical Reviews. 109 (6): 2551—2651. PMID 19382806. doi:10.1021/cr800278z.
- ^ Raber, Douglas J.; Gariano, Jr, Patrick; Brod, Albert O.; Gariano, Anne L.; Guida, Wayne C. (1977). „Esterification of Carboxylic Acids with Trialkyloxonium Salts: Ethyl and Methyl 4-Acetoxybenzoates”. Organic Syntheses. 56: 59. doi:10.15227/orgsyn.056.0059.
- ^ Matsumoto, Kouichi; Shimazaki, Hayato; Miyamoto, Yu; Shimada, Kazuaki; Haga, Fumi; Yamada, Yuki; Miyazawa, Hirotsugu; Nishiwaki, Keiji; Kashimura, Shigenori (2014). „Simple and Convenient Synthesis of Esters from Carboxylic Acids and Alkyl Halides Using Tetrabutylammonium Fluoride”. Journal of Oleo Science (на језику: енглески). 63 (5): 539—544. ISSN 1345-8957. PMID 24770480. doi:10.5650/jos.ess13199 .
- ^ Katole, Dhiraj O.; Yadav, Ganapati D. (2019). „Process intensification and waste minimization using liquid-liquid-liquid tri-phase transfer catalysis for the synthesis of 2-((benzyloxy)methyl)furan”. Molecular Catalysis. 466: 112—21. doi:10.1016/j.mcat.2019.01.004.
- ^ J. O. Metzger (1998). „Solvent-Free Organic Syntheses”. Angewandte Chemie International Edition. 37 (21): 2975—2978. PMID 29711128. doi:10.1002/(SICI)1521-3773(19981116)37:21<2975::AID-ANIE2975>3.0.CO;2-A.
- ^ Mieczyslaw Makosza (2000). „Phase-transfer catalysis. A general green methodology in organic synthesis”. Pure Appl. Chem. 72 (7): 1399—1403. doi:10.1351/pac200072071399 .
- ^ Finkelstein, Hans (1910). „Darstellung organischer Jodide aus den entsprechenden Bromiden und Chloriden”. Ber. Dtsch. Chem. Ges. (на језику: German). 43 (2): 1528—1532. doi:10.1002/cber.19100430257.
- ^ Ervithayasuporn, V. (2013). „One-pot synthesis of halogen exchanged silsesquioxanes: octakis(3-bromopropyl)octasilsesquioxane and octakis(3-iodopropyl)octasilsesquioxane”. Dalton Trans. 42 (37): 13747—13753. PMID 23907310. doi:10.1039/C3DT51373D.
- ^ B. H. Lipshutz; M. R. Wood; R. Tirado (1999). „Copper-catalyzed Conjugate Addition of Functionalized Organozinc Reagents to α,β-Unsaturated Ketones: Ethyl 5-(3-oxocyclohexyl)pentanoate”. Org. Synth. 76: 252. doi:10.15227/orgsyn.076.0252.
- ^ Streitwieser, A. (1956). „Solvolytic Displacement Reactions at Saturated Carbon Atoms”. Chem. Rev. 56 (4): 571—752. doi:10.1021/cr50010a001.
- ^ Bordwell, F. G.; Brannen, W. T. (1964). „The Effect of the Carbonyl and Related Groups on the Reactivity of Halides in SN2 Reactions”. J. Am. Chem. Soc. 86 (21): 4645—4650. doi:10.1021/ja01075a025.
- ^ Otera, Junzo. (јун 1993). „Transesterification”. Chemical Reviews. 93 (4): 1449—1470. doi:10.1021/cr00020a004.
- ^ „ENZYME – 3.1.1.3 Triacylglycerol lipase”. enzyme.expasy.org. SIB Swiss Institute of Bioinformatics. Приступљено 2021-02-17.
- ^ Ahmad, Shahbaz; Bühl, Michael (2021). „Computational modelling of Pd-catalysed alkoxycarbonylation of alkenes and alkynes”. Physical Chemistry Chemical Physics (на језику: енглески). 2021-08-04 (30): 15869—15880. Bibcode:2021PCCP...2315869A. ISSN 1463-9084. PMID 34318843. S2CID 236472958. doi:10.1039/D1CP02426D . hdl:10023/23678 .
- ^ Scott D. Barnicki (2012). „Synthetic Organic Chemicals”. Ур.: James A. Kent. Handbook of Industrial Chemistry and Biotechnology (12th изд.). New York: Springer. ISBN 978-1-4614-4259-2.
- ^ Kiss, Gabor (2001). „Palladium-Catalyzed Reppe Carbonylation”. Chemical Reviews. 101 (11): 3435—3456. PMID 11840990. doi:10.1021/cr010328q.
- ^ „Vinyl Esters”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. стр. 1—16. doi:10.1002/14356007.a27_419.pub2.
- ^ Seki, Tsunetake; Nakajo, Tetsuo; Onaka, Makoto (2006). „The Tishchenko Reaction: A Classic and Practical Tool for Ester Synthesis”. Chemistry Letters. 35 (8): 824—829. doi:10.1246/cl.2006.824.
- ^ Mlynarski, Jacek (2006). „Direct Asymmetric Aldol-Tishchenko Reaction”. European Journal of Organic Chemistry (21): 4779—4786. doi:10.1002/ejoc.200600258.
- ^ Hattori, Hideshi (2001). „Solid base catalysts: Generation of basic sites and application to organic synthesis”. Applied Catalysis A: General. 222 (1–2): 247—259. doi:10.1016/S0926-860X(01)00839-0.
- ^ а б Kamm, O.; Kamm, W. F. (1922). „Benzyl benzoate”. Organic Syntheses. 2: 5. doi:10.15227/orgsyn.002.0005.
- ^ Cope, Arthur (1960). Organic Reaction Volume XI (1 изд.). New York: Wiley-Interscience. ISBN 9780471171270. doi:10.1002/jps.2600500225.
- ^ Wohllebe, J; Garbisch, E. W. (1977). „Ring Contraction via a Favorskii-Type Rearrangement: Cycloundecanone”. Org. Synth. 56: 107. doi:10.15227/orgsyn.056.0107.; Coll. Vol., 6, стр. 368
- ^ Shioiri, Takayuki; Kawai, Nobutaka (1978). „New methods and reagents in organic synthesis. 2. A facile conversion of alkyl aryl ketones to α-arylalkanoic acids using diphenyl phosphorazidate. Its application to a new synthesis of ibuprofen and naproxen, nonsteroidal antiinflammatory agents”. J. Org. Chem. 43 (14): 2936—2938. doi:10.1021/jo00408a049.
- ^ Hamada, Yasumasa; Shioiri, Takayuki (1982). „Cycloundecanecarboxylic Acid”. Org. Synth. 62: 191. doi:10.15227/orgsyn.062.0191.; Coll. Vol., 7, стр. 135
- ^ Goheen, D. W.; Vaughan, W. R. (1963). „Cyclopentanecarboxylic acid, methyl ester”. Org. Synth. 39: 37. doi:10.15227/orgsyn.039.0037.; Coll. Vol., 4, стр. 594
- ^ Kürti, László; Czakó, Barbara (2005). Strategic Applications of Named Reactions in Organic Synthesis . Burlington; San Diego; London: Elsevier Academic Press. стр. 28. ISBN 978-0-12-369483-6.
- ^ Krow, Grant R. (1993). „The Baeyer-Villiger Oxidation of Ketones and Aldehydes”. Organic Reactions. 43 (3): 251—798. ISBN 0471264180. doi:10.1002/0471264180.or043.03.
- ^ Carey, Francis A.; Sundberg, Richard J. (2007). Advanced Organic Chemistry: Part B: Reactions and Synthesis (5th изд.). New York: Springer. стр. 1135. ISBN 978-0387683546.
- ^ „Pinner Reaction”. Comprehensive Organic Name Reactions and Reagents (504): 2237—2240. 2010. ISBN 9780470638859. doi:10.1002/9780470638859.conrr504.
- ^ A. Pinner, F. Klein; Klein (1877). „Umwandlung der Nitrile in Imide”. 10 (2): 1889—1897. doi:10.1002/cber.187701002154.
- ^ A. Pinner, Fr. Klein; Klein (1878). „Umwandlung der Nitrile in Imide”. 11 (2): 1475—1487. doi:10.1002/cber.18780110258.
- ^ A. Pinner (1883). „Ueber die Umwandlung der Nitrile in Imide”. 16 (2): 1643—1655. doi:10.1002/cber.18830160235.
- ^ Roger, R.; Neilson, D. G. (1961). „The Chemistry of Imidates”. Chem. Rev. 61 (2): 179—211. doi:10.1021/cr60210a003.
- ^ Adams, Roger; Thal, A. F. (1922). „Ethyl Phenylacetate”. Organic Syntheses. 2: 27. doi:10.15227/orgsyn.002.0027.
- ^ Elvidge, J. A.; Linstead, R. P. (1954). „Heterocyclic imines and amines. Part III. Succinimidine”. Journal of the Chemical Society (Resumed): 442. doi:10.1039/JR9540000442.
- ^ Spessard, Gary O.; Miessler, Gary L. (2010). Organometallic Chemistry. Oxford University Press. стр. 285–289. ISBN 978-0-19-533099-1.
- ^ Xu, Ruren; Pang, Wenqin; Huo, Qisheng (13. 1. 2011). Modern Inorganic Synthetic Chemistry. Elsevier. стр. 275—278. ISBN 978-0-444-53599-3.
- ^ Ignatyev, Igor; Charlie Van Doorslaer; Pascal G.N. Mertens; Koen Binnemans; Dirk. E. de Vos (2011). „Synthesis of glucose esters from cellulose in ionic liquids” . Holzforschung. 66 (4): 417—425. S2CID 101737591. doi:10.1515/hf.2011.161.
- ^ Bailey, P. S.; Erickson, R. E. (1973). „Diphenaldehyde”. Org. Synth.; Coll. Vol., 5, стр. 489
- ^ Tietze, L. F.; Bratz, M. (1998). „Dialkyl Mesoxalates by Ozonolysis of Dialkyl Benzalmalonates”. Org. Synth.; Coll. Vol., 9, стр. 314
- ^ Harwood, Laurence M.; Moody, Christopher J. (1989). Experimental Organic Chemistry: Principles and Practice (Illustrated изд.). Wiley-Blackwell. стр. 55–57. ISBN 978-0632020171.
- ^ Neumeister, Joachim; Keul, Helmut; Pratap Saxena, Mahendra; Griesbaum, Karl (1978). „Ozone Cleavage of Olefins with Formation of Ester Fragments”. Angewandte Chemie International Edition in English. 17 (12): 939—940. doi:10.1002/anie.197809392.
- ^ Sperry, Jeffrey B.; Wright, Dennis L. (2006). „The application of cathodic reductions and anodic oxidations in the synthesis of complex molecules”. Chem. Soc. Rev. 35 (7): 605—621. PMID 16791332. doi:10.1039/b512308a.
- ^ Topics in current chemistry. Electrochemistry, Vol. 3 (Topics in Current Chemistry, Vol. 148) E. Steckhan (Ed), Springer, NY 1988.
- ^ Yan, M.; Kawamata, Y.; Baran, P. S. (2017). „Synthetic Organic Electrochemistry: Calling All Engineers.”. Angewandte Chemie International Edition. 57 (16): 4149—4155. PMC 5823775 . PMID 28834012. doi:10.1002/anie.201707584.
- ^ Utley, James (1997). „Trends in Organic Electrosynthesis”. Chemical Society Reviews. 26 (3): 157. doi:10.1039/cs9972600157.
- ^ Makhova, Irina V.; Elinson, Michail N.; Nikishin, Gennady I. (1991). „Electrochemical oxidation of ketones in methanol in the presence of alkali metal bromides”. Tetrahedron. 47 (4–5): 895—905. doi:10.1016/S0040-4020(01)87078-2.
- ^ Hui, Y.H. (2006), Handbook of Food Science, Technology, and Engineering, Vol.1, Boca Raton: Taylor & Francis, ISBN 1-57444-551-0
- ^ T. L. Husum, L. S. Pedersen, P. M. Nielsen, M. W. Christensen, D. Kristensen, and H. C. Holm (2003): "Enzymatic interesterification: Process advantages and product benefits." Архивирано 2006-01-04 на сајту Wayback Machine . Palm Oil Information Online Service. Retrieved 2010-10-20.
- ^ W. Hamm and R. Hamilton, editors (2000). Edible Oil Processing. ISBN 1-84127-038-5.
- ^ Rousseau, D. : "The Effects of Interesterification on the Physical Properties of Fats". Chapter 13 of. Physical Properties of Lipids. CRC Press. 2002.
- ^ Institute of Shortenings and Edible oils (2006). „Food Fats and oils” (PDF). Архивирано из оригинала (PDF) 2007-03-26. г. Приступљено 2009-02-19.
- ^ Costales-Rodriquez, R.; Gibon, V.; Verhe, R.; De Greyt, W. (2009), „Chemical and Enzymatic Interesterification of a Blend of Palm Stearin: Soybean Oil for Low Trans-Margarine Formulation.”, J Am Oil Chem Soc, 86 (7): 681—697, doi:10.1007/s11746-009-1395-2
- ^ а б Wade 2010, pp. 1005–1009.
- ^ Emil Fischer, Arthur Speier (1895). „Darstellung der Ester”. 28 (3): 3252—3258. doi:10.1002/cber.189502803176.
- ^ Offenhauer, Robert D. (1964). „The direct esterification of phenols”. 41 (1): 39. Bibcode:1964JChEd..41...39O. doi:10.1021/ed041p39.
- ^ Hocking, M.B. (1980). „Phenyl acetate preparation from phenol and acetic acid: Reassessment of a common textbook misconception”. 57 (7): 527. Bibcode:1980JChEd..57..527H. doi:10.1021/ed057p527.
- ^ Furniss, Brian; Hannaford, Antony; Smith, Peter; Tatchell, Austin (1996). Vogel's Textbook of Practical Organic Chemistry 5th Ed. London: Longman Science & Technical. стр. 695–697 & 699–704. ISBN 9780582462366.
- ^ Tingle, J. Bishop (1906). „Reports: Esterification”. American Chemical Journal. 35: 368—369. Приступљено 19. 1. 2016.
- ^ Munson, James W. (1992). „Hydroxamic acids”. Ур.: S. Patai. Acid Derivatives (1992), Volume 2. PATAI'S Chemistry of Functional Groups. стр. 849—873. ISBN 9780470772508. doi:10.1002/9780470772508.ch15.
- ^ C. R. Hauser; W. B. Renfrow Jr (1939). „Benzohydroxamic Acid”. Org. Synth. 19: 15. doi:10.15227/orgsyn.019.0015.
- ^ Wang, Zerong (2010). Comprehensive organic name reactions and reagents. John Wiley & Sons, Inc. стр. 1772—1776. ISBN 9780471704508.
- ^ Yale, H. L. (1943). „The Hydroxamic Acids”. Chem. Rev. 33 (3): 209—256. doi:10.1021/cr60106a002.
- ^ Bauer, L.; Exner, O. (1974). „The Chemistry of Hydroxamic Acids and N-Hydroxyimides”. Angew. Chem. Int. Ed. Engl. 13 (6): 376. doi:10.1002/anie.197403761.
- ^ Shioiri, Takayuki (1991). „Degradation Reactions”. Comprehensive Organic Synthesis. 6: 795—828. ISBN 9780080359298. doi:10.1016/B978-0-08-052349-1.00172-4.
- ^ Hauser, C. R.; Renfrow, Jr.., W. B. (1939). „Benzohydroxamic Acid”. Organic Syntheses. 19: 15. doi:10.15227/orgsyn.019.0015.
- ^ Goebel, M. T.; Marvel, C. S. (1933). „The Oxidation of Grignard Reagents”. Journal of the American Chemical Society. 55 (4): 1693—1696. doi:10.1021/ja01331a065.
- ^ Smith, David H. (1999). „Grignard Reactions in "Wet" Ether”. Journal of Chemical Education. 76 (10): 1427. Bibcode:1999JChEd..76.1427S. doi:10.1021/ed076p1427.
- ^ Philip E. Rakita (1996). „5. Safe Handling Practices of Industrial Scale Grignard Ragents” (Google Books excerpt). Ур.: Gary S. Silverman; Philip E. Rakita. Handbook of Grignard reagents. CRC Press. стр. 79—88. ISBN 0-8247-9545-8.
- ^ Wang, Zerong, ур. (2009). „109. Bouveault–Blanc Reduction”. Comprehensive Organic Name Reactions and Reagents. стр. 493—496. ISBN 978-0-471-70450-8. doi:10.1002/9780470638859.conrr109.
- ^ Bouveault, L.; Blanc, G. (1903). „Préparation des alcools primaires au moyen des acides correspondants” [Preparation of primary alcohols by means of the corresponding acids]. Compt. Rend. (на језику: French). 136: 1676—1678.
- ^ Bouveault, L.; Blanc, G. (1903). „Préparation des alcools primaires au moyen des acides correspondants” [Preparation of primary alcohols by means of the corresponding acids]. Compt. Rend. (на језику: French). 137: 60—62.
- ^ Bouveault, L.; Blanc, G. (1904). „Transformation des acides monobasiques saturés dans les alcools primaires correspondants” [Transforming saturated monobasic acids into the corresponding primary alcohols]. Bull. Soc. Chim. Fr. (на језику: French). 31: 666—672.
- ^ Bouveault, L.; Blanc, G. (1904). „Hydrogénation des éthers des acides possédant en outre les fonctions éther-oxyde ou acétal” [Hydrogenation of the ether of the acids furthermore possessing the ether-oxide or acetal functions]. Bull. Soc. Chim. Fr. (на језику: French). 31 (3): 1210—1213.
- ^ Reid, E. E.; Cockerille, F. O.; Meyer, J. D.; Cox, W. M.; Ruhoff, J. R. (1935). „Oleyl Alcohol”. Organic Syntheses. 15: 51. doi:10.15227/orgsyn.015.0051.
- ^ Adkins, Homer; Gillespie, R. H. (1949). „Oleyl alcohol”. Organic Syntheses. 29: 80. doi:10.15227/orgsyn.029.0080.
- ^ Ford, S. G.; Marvel, C. S. (1930). „Lauryl Alcohol”. Organic Syntheses. 10: 62. doi:10.15227/orgsyn.010.0062.
- ^ W. Reusch. „Carboxyl Derivative Reactivity”. Virtual Textbook of Organic Chemistry. Архивирано из оригинала 2016-05-16. г.
- ^ Yato, Michihisa; Homma, Koichi; Ishida, Akihiko (јун 2001). „Reduction of carboxylic esters to ethers with triethyl silane in the combined use of titanium tetrachloride and trimethylsilyl trifluoromethanesulfonate”. Tetrahedron. 57 (25): 5353—5359. doi:10.1016/S0040-4020(01)00420-3.
- ^ Sakai, Norio; Moriya, Toshimitsu; Konakahara, Takeo (јул 2007). „An Efficient One-Pot Synthesis of Unsymmetrical Ethers: A Directly Reductive Deoxygenation of Esters Using an InBr3/Et3SiH Catalytic System”. The Journal of Organic Chemistry. 72 (15): 5920—5922. PMID 17602594. doi:10.1021/jo070814z.
- ^ Carey, F. A. (2006). Organic Chemistry (6th изд.). New York, NY: McGraw-Hill. ISBN 0-07-111562-5.
- ^ Claisen, L.; Claparede, A. (1881). „Condensationen von Ketonen mit Aldehyden”. Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 2460—2468. doi:10.1002/cber.188101402192.
- ^ Claisen, L. (1887). „Ueber die Einführung von Säureradicalen in Ketone”. Berichte der Deutschen Chemischen Gesellschaft. 20 (1): 655—657. doi:10.1002/cber.188702001150.
- ^ Hauser, C. R.; Hudson, B. E. Jr. (1942). „The Acetoacetic Ester Condensation and Certain Related Reactions”. Organic Reactions. 1: 266—302. ISBN 0471264180. doi:10.1002/0471264180.or001.09.
- ^ Riemenschneider, Wilhelm; Bolt, Hermann M. (2005). „Esters, Organic”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a09_565.pub2.
- ^ Kwart, Harold; King, Kenneth (1969). „Rearrangement and cyclization reactions of carboxylic acids and esters”. Ур.: S. Patai. PATAI'S Chemistry of Functional Groups: Carboxylic Acids and Esters (1969). стр. 341—373. ISBN 9780470771099. doi:10.1002/9780470771099.ch8.
- ^ Schaefer, J. P.; Bloomfield, J. J. (1967). „The Dieckmann Condensation (Including the Thorpe-Ziegler Condensation)”. Organic Reactions. 15: 1—203. ISBN 0471264180. doi:10.1002/0471264180.or015.01.
- ^ Janice Gorzynski Smith (2007). Organic Chemistry (2nd изд.). McGraw-Hill. стр. 932–933. ISBN 978-0073327495.
- ^ Carey 2006, pp. 919–924.
- ^ Baker, W. (1933). „Molecular rearrangement of some o-acyloxyacetophenones and the mechanism of the production of 3-acylchromones”. J. Chem. Soc.: 1381—1389. doi:10.1039/JR9330001381.
- ^ Mahal, H. S.; Venkataraman, K. (1934). „Synthetical experiments in the chromone. group. XIV. Action of sodamide on 1-acyloxy-2-acetonaphthones”. J. Chem. Soc.: 1767—1769. doi:10.1039/JR9340001767.
- ^ Wheeler, T. S. (1952). „Flavone”. Organic Syntheses. 32: 72. doi:10.15227/orgsyn.032.0072. (also in the Collective Volume (1963) 4: 478 (PDF)).
- ^ Jain, P. K.; Makrandi, J. K. (1982). „A Facile Baker-Venkataraman Synthesis of Flavones using Phase Transfer Catalysis”. Synthesis. 1982 (3): 221—222. doi:10.1055/s-1982-29755.
- ^ Kalinin, A. V.; Da Silva, A. J. M.; Lopes, C. C.; Lopes, R. S. C.; Snieckus, V. (1998). „Directed ortho metalation – cross coupling links. Carbamoyl rendition of the Baker-Venkataraman rearrangement. Regiospecific route to substituted 4-hydroxycoumarins”. Tetrahedron Letters. 39 (28): 4995—4998. doi:10.1016/S0040-4039(98)00977-0.
- ^ Kraus, G. A.; Fulton, B. S.; Wood, S.H. (1984). „Aliphatic acyl transfer in the Baker-Venkataraman reaction”. J. Org. Chem. 49 (17): 3212—3214. doi:10.1021/jo00191a033.
- ^ Reddy, B.P.; Krupadanam, G.L.D. (1996). „The synthesis of 8-allyl-2-styrylchromones by the modified baker-venkataraman transformation”. J. Heterocycl. Chem. 33 (6): 1561. doi:10.1002/jhet.5570330602.
- ^ Kalinin, A.V.; Sneckus, V. (1998). „4,6-Dimethoxy-3,7-dimethylcoumarin from Colchicum decaisnei. Total synthesis by carbamoyl Baker-Venkataraman rearrangement and structural revision to isoeugenetin methyl ether”. Tetrahedron Lett. 39 (28): 4999. doi:10.1016/S0040-4039(98)00978-2.
- ^ Thasana, N.; Ruchirawat, S. (2002). „The application of the Baker–Venkataraman rearrangement to the synthesis of benz[b]indeno[2,1-e]pyran-10,11-dione”. Tetrahedron Lett. 43 (25): 4515. doi:10.1016/S0040-4039(02)00818-3.
- ^ Santos, C.M.M.; Silva, A.M.S.; Cavaleiro, J.A.S. (2003). „Synthesis of New Hydroxy-2-styrylchromones”. Eur. J. Org. Chem. (23): 4575—4585. doi:10.1002/ejoc.200300468. hdl:10198/3932 .
- ^ Santos, Clementina M.; Silva, Artur M. S. (2017). „An Overview of 2-Styrylchromones: Natural Occurrence,Synthesis, Reactivity and Biological Properties”. Eur. J. Org. Chem. 2017 (22): 3115—3133. doi:10.1002/ejoc.201700003. hdl:10198/14517 — преко Reaxys.
- ^ Kürti and Czakó 2005, p. 30.
- ^ Lee, S.D.; Chan, T.H.; Kwon, K.S. (1984). „Rearrangement of α-acyloxyacetates into 2-hydroxy-3-ketoesters”. Tetrahedron Letters. 25 (32): 3399—3402. doi:10.1016/S0040-4039(01)91030-5.)
- ^ Holton, Robert A.; Somoza, Carmen; Kim, Hyeong Baik; Liang, Feng; Biediger, Ronald J.; Boatman, P. Douglas; Shindo, Mitsuru; Smith, Chase C.; Kim, Soekchan (1994). „First total synthesis of taxol. 1. Functionalization of the B ring”. Journal of the American Chemical Society. 116 (4): 1597—1598. doi:10.1021/ja00083a066.)
- ^ House, Herbert O. (1972). Modern Synthetic Reactions . Menlo Park, CA.: W. A. Benjamin. ISBN 0-8053-4501-9.
- ^ „Malonic Ester Synthesis”. Organic Chemistry Portal. Приступљено 2007-10-26.
- ^ Fráter, G.; Müller, U.; Günther, W. (1984). „The stereoselective α-alkylation of chiral β-hydroxy esters and some applications thereof”. Tetrahedron. 40 (8): 1269—1277. doi:10.1016/S0040-4020(01)82413-3.
- ^ Seebach, Dieter; Wasmuth, Daniel (1980). „Herstellung von erythro-2-Hydroxybernsteinsäure-Derivaten aus Äpfelsäureester. Vorläufige Mitteilung”. Helvetica Chimica Acta (на језику: German). 63 (1): 197—200. doi:10.1002/hlca.19800630118.
- ^ Mundy, Bradford; Ellerd, Michael; Favaloro, Frank (2005). Name Reactions and Reagents in Organic Synthesis. John Wiley & Sons. стр. 252—253. ISBN 9780471228547.
- ^ Crimmins, Michael; Vanier, Grace (2006). „Enantioselective Total Synthesis of (+)-SCH 351448”. Organic Letters. 8 (13): 2887—2890. PMID 16774282. doi:10.1021/ol061073b.
- ^ Raghavan, Sadagopan; Rathore, Kailash (2009). „Asymmetric synthesis of (−)-tetrahydrolipstatin”. Tetrahedron. 65 (48): 10083—10092. doi:10.1016/j.tet.2009.09.062.
- ^ Wood, J. L.; Khatri, N. A.; Weinreb, S. M. (1979). „A direct conversion of esters to nitriles”. 20 (51): 4907. doi:10.1016/S0040-4039(01)86746-0.
- ^ Poon, Po. S.; Banerjee, Ajoy K.; Laya, Manuel S. (2011). „Advances in the Krapcho Decarboxylation”. Journal of Chemical Research (на језику: енглески) (2): 67—73. ISSN 1747-5198. doi:10.3184/174751911X12964930076403.
- ^ Hansen, Thomas; Roozee, Jasper C.; Bickelhaupt, F. Matthias; Hamlin, Trevor A. „How Solvation Influences the S N 2 versus E2 Competition”. The Journal of Organic Chemistry (на језику: енглески). 2022-02-04 (3): 1805—1813. ISSN 0022-3263. PMC 8822482 . PMID 34932346. doi:10.1021/acs.joc.1c02354.
- ^ Olejar, Kenneth J.; Kinney, Chad A. (2021). „Evaluation of thermo-chemical conversion temperatures of cannabinoid acids in hemp (Cannabis sativa L.) biomass by pressurized liquid extraction”. Journal of Cannabis Research (на језику: енглески) (1): 40. ISSN 2522-5782. PMC 8408919 . PMID 34465400. doi:10.1186/s42238-021-00098-6 .
- ^ Dunn, Gerald E.; Thimm, Harald F. „Kinetics and mechanism of decarboxylation of some pyridinecarboxylic acids in aqueous solution. II”. Canadian Journal of Chemistry (на језику: енглески). 1977-04-15 (8): 1342—1347. ISSN 0008-4042. doi:10.1139/v77-185.
- ^ Krapcho, A. Paul; Weimaster, J. F.; Eldridge, J. M.; Jahngen, E. G. E.; Lovey, A. J.; Stephens, W. P. (1978-01-01). „Synthetic applications and mechanism studies of the decarbalkoxylations of geminal diesters and related systems effected in dimethyl sulfoxide by water and/or by water with added salts”. The Journal of Organic Chemistry. 43 (1): 138—147. ISSN 0022-3263. doi:10.1021/jo00395a032.
- ^ Fries, K.; Finck, G. (1908). „Über Homologe des Cumaranons und ihre Abkömmlinge”. 41 (3): 4271—4284. doi:10.1002/cber.190804103146.
- ^ Fries, K.; Pfaffendorf, W. (1910). „Über ein Kondensationsprodukt des Cumaranons und seine Umwandlung in Oxindirubin”. 43 (1): 212—219. doi:10.1002/cber.19100430131.
- ^ March, J. Advanced Organic Chemistry, 3rd Ed.; John Wiley & Sons: Chichester, 1985; pp. 499ff.
- ^ Blatt, A. H. Org. React. 1942, 1.
- ^ Organic Syntheses, Coll. Vol. 3, p.30 (1955); Vol. 29, p.2 (1949). Link
- ^ Organic Syntheses, Coll. Vol. 4, p.746 (1963); Vol. 38, p.78 (1958). Link
- ^ Organic Syntheses, Coll. Vol. 5, p.235 (1973); Vol. 43, p.17 (1963). Link
- ^ Bouveault, L.; Locquin, R. (1905). „Action du sodium sur les éthers des acides monobasiques à fonction simple de la série grasse” [Effect of sodium on the ethers of single-function monobasic acids of the fatty series] (на језику: француски). 140: 1593—1595.
- ^ Finley, K. T. (1964). „The Acyloin Condensation as a Cyclization Method”. 64 (5): 573—589. doi:10.1021/cr60231a004.
- ^ Bloomfield, J. J.; Owsley, D. C.; Nelke, J. M. Org. React. 1976, 23.
- ^ Theodora W. Greene; Peter G. M. Wuts (1999). Protecting Groups in Organic Synthesis (3 изд.). J. Wiley. ISBN 978-0-471-16019-9.
- ^ Chan, Weng C.; White, Peter D. (2004). Fmoc Solid Phase Peptide Synthesis. Oxford University Press. ISBN 978-0-19-963724-9.