Molekulska orbitala
U hemiji, molekulska orbitala (skr. MO) je matematička funkcija koja opisuje ponašanje elektrona kao talasa u molekulu.[1][2][3] Ova funkcija se može koristiti za izračunavanje fizičkih i hemijskih osobina kao što je nalaženje elektrona u određenom delu prostora. Molekulske orbitale se najčešće konstruišu kombinacijom atomskih ili hibridnih orbitala svakog od atoma u datom molekulu.[4][5] Termine atomska orbitala i molekularna orbitala[a] uveo je Robert S. Maliken 1932. da označavaju jednoelektronske orbitalne talasne funkcije.[7] Na elementarnom nivou, oni se koriste za opisivanje oblasti prostora u kojoj funkcija ima značajnu amplitudu.
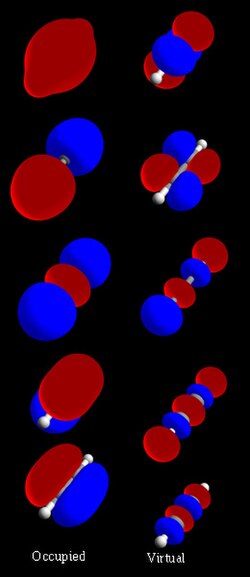
Na elementarnom nivou, molekulska orbitala se koristi za opisivanje prostora u kome funkcija ima značajnu amplitudu. U izolovanom atomu lokacija orbitalnih elektrona određena je funkcijama koje se nazivaju atomske orbitale. Kada se više atoma hemijski kombinuje u molekul, lokacije elektrona određuju molekul u celini, tako da se atomske orbitale kombinuju i formiraju molekularne orbitale. Elektroni iz sastavnih atoma zauzimaju molekularne orbitale. Matematički, molekularne orbitale su približno rešenje Šredingerove jednačine za elektrone u polju atomskih jezgara molekula. One se obično grade kombinujući atomske orbitale ili hibridne orbitale iz svakog atoma molekula ili druge molekularne orbitale iz grupa atoma. One se mogu kvantitativno izračunati pomoću Hartri-Fokovovog ili metoda samokonzistentnih polja (SCF).
Pregled
urediMolekularna orbitala (MO) se može koristiti za predstavljanje regiona u molekulu gde će se verovatno naći elektron koji zauzima tu orbitalu. Molekularne orbitale su približna rešenja Šredingerove jednačine za elektrone u električnom polju atomskih jezgara molekula. Međutim, izračunavanje orbitala direktno iz ove jednačine je previše izazovan problem. Umesto toga, one se dobijaju kombinacijom atomskih orbitala, koje predviđaju lokaciju elektrona u atomu. Molekulska orbitala može odrediti elektronsku konfiguraciju molekula: prostornu distribuciju i energiju jednog (ili para) elektrona. Molekularne orbitale se najčešće predstavljaju kao [[[Linear combination of atomic orbitals molecular orbital method|linearna kombinacija atomskih orbitala]] (LCAO-MO metoda), posebno u kvalitativnoj ili vrlo približnoj upotrebi. Oni su od neprocenjive vrednosti u pružanju jednostavnog modela vezivanja u molekulima, shvaćenog kroz molekularnu orbitalnu teoriju. Većina savremenih metoda u računarskoj hemiji počinje izračunavanjem molekulskih orbitala sistema. Molekulska orbitala opisuje ponašanje jednog elektrona u električnom polju koje stvaraju jezgra i neku prosečnu distribuciju ostalih elektrona. U slučaju da dva elektrona zauzimaju istu orbitalu, Paulijev princip zahteva da imaju suprotan spin. Ovo je nužno aproksimacija, a veoma precizni opisi molekularne elektronske talasne funkcije nemaju orbitale (pogledajte konfiguracionu interakciju).
Molekularne orbitale su, generalno, delokalizovane kroz ceo molekul. Štaviše, ako molekul ima elemente simetrije, njegove nedegenerisane molekularne orbitale su bilo simetrične ili antisimetrične u odnosu na bilo koju od ovih simetrija. Drugim rečima, primena operacije simetrije S (npr. refleksija, rotacija ili inverzija) na molekularnu orbitalu ψ dovodi do toga da molekularna orbitala ostane nepromenjena ili da obrne svoj matematički predznak: Sψ = ±ψ. U planarnim molekulima, na primer, molekularne orbitale su ili simetrične (sigma) ili antisimetrične (pi) u odnosu na refleksiju u molekularnoj ravni. Ako se uzmu u obzir i molekuli sa degenerisanim orbitalnim energijama, važi opštija tvrdnja da molekularne orbitale formiraju baze za nesvodljive reprezentacije grupe simetrije molekula.[9] Svojstva simetrije molekularnih orbitala znače da je delokalizacija inherentna karakteristika teorije molekularnih orbita i čini je fundamentalno različitom od (i komplementarnom) teoriji valentne veze,[10][11] u kojoj se veze posmatraju kao lokalizovani elektronski parovi, uz uzimanje u obzir rezonancije kojom se objašnjava delokalizacija.
Za razliku od ovih kanonskih molekularnih orbitala prilagođenih simetriji, lokalizovane molekularne orbitale mogu se formirati primenom određenih matematičkih transformacija na kanonske orbitale.[12][13][14] Prednost ovog pristupa je u tome što će orbitale bliže odgovarati „vezama” molekula kao što je prikazano Luisovom strukturom. Nedostatak je da nivoi energije ovih lokalizovanih orbitala više nemaju fizičko značenje. (Diskusija u ostatku ovog članka će se fokusirati na kanonske molekularne orbitale. Za dalje diskusije o lokalizovanim molekularnim orbitalama, pogledajte: orbitala prirodne veze i sigma-pi i ekvivalentni orbitalni modeli.)
Formiranje molekularnih orbitala
urediMolekularne orbitale nastaju iz dozvoljenih interakcija između atomskih orbitala, koje su dozvoljene ako su simetrije (utvrđene iz teorije grupa) atomskih orbitala kompatibilne jedna sa drugom. Efikasnost atomskih orbitalnih interakcija se određuje na osnovu preklapanja (mera koliko dobro dve orbitale konstruktivno interaguju jedna sa drugom) između dve atomske orbitale, što je značajno ako su atomske orbitale bliske po energiji. Konačno, broj formiranih molekularnih orbitala mora biti jednak broju atomskih orbitala u atomima koji se kombinuju da bi se formirao molekul.
Kvalitativni opis
urediSve talasno mehaničke odnosno talasno mehaničke zakonitosti koje važe za atom, važe i za složeniji sistem — molekul. To znači da su prema ovoj teoriji i metodi elektroni raspoređeni u molekulu kao i u atomu po odgovarajućim orbitalama. Osnovna razlika je što su atomske orbitale monocentrične, a molekulske su policentrične tj. izgrađuju se oko dva ili više atomskih jezgara.
Molekulske orbitale se mogu dobiti metodom linearne kombinacije atomskih orbitala. Kao rezultat kombinacije dvije atomske orbitale, dobijaju se dvije molekulske orbitale predstavljene zbirom odnosno razlikom atomskih orbitala. Broj molekulskih orbitala koje nastaju je jednak broju atomskih orbitala koje su uključene u linearnu kombinaciju.[15]
Pri građenju molekulske orbitale, u odnosu na atomsku orbitalu dolazi do slijedećih promijena:
- gubi se centralna simetrija Kulonovskog potencijala (kvantni broj l više nije dobar kvantni broj za opis)
- elektroni su istovremeno pridruženi na oba atoma
- dolazi do cijepanja degenerisanih energetskih nivoa
Linearne kombinacije atomskih orbitala (LCAO)
urediMolekularne orbitale su prvi uveli Fridrih Hund[16][17] i Robert S. Muliken[18][19] 1927. i 1928. godine.[20][21] Linearnu kombinaciju atomskih orbitala ili „LCAO”[22][23] aproksimaciju za molekularne orbitale uveo je 1929. godine Džon Lenard-Džouns.[24] Njegov revolucionarni rad pokazao je kako se iz kvantnih principa može izvesti elektronska struktura molekula fluora i kiseonika. Ovaj kvalitativni pristup molekularno orbitalnoj teoriji je deo početka moderne kvantne hemije.
Linearne kombinacije atomskih orbitala (LCAO) mogu se koristiti za procenu molekulskih orbitala koje nastaju vezanjem između sastavnih atoma molekula. Slično atomskoj orbitali, Šredingerova jednačina koja opisuje ponašanje elektrona takođe se može konstruisati za molekularnu orbitalu. Linearne kombinacije atomskih orbitala, ili zbirovi i razlike atomskih talasnih funkcija pružaju približna rešenja Hartri-Fokovih jednačina koja odgovaraju aproksimaciji nezavisnih čestica molekularne Šredingerove jednačine. Za jednostavne dijatomske molekule dobijene talasne funkcije su matematički predstavljene jednačinama
gde su i molekularne talasne funkcije za vezujuće i antivezujuće molekularne orbitale, i su atomske talasne funkcije od atoma a i b, a i su podesivi koeficijenti. Ovi koeficijenti mogu biti pozitivni ili negativni, zavisno od energije i simetrije pojedinih atomskih orbitala. Kako se dva atoma zbližavaju, njihove atomske orbitale se preklapaju da bi stvorile područja visoke gustine elektrona, i kao posledica toga između dva atoma se formiraju molekularne orbitale. Atomi se drže zajedno pomoću elektrostatičke privlačnosti između pozitivno naelektrisanih jezgara i negativno naelektrisanih elektrona koji zauzimaju vezujuće molekularne orbitale.[4]
Vezujuće, antivezujuće i nevezujući molekulske orbitale
urediKada atomske orbitale interaguju, rezultujuća molekularna orbitala može biti tri tipa: vezujuća, antivezujuća ili nevezujuća.
- Interakcije vezivanja između atomskih orbitala su konstruktivne (u fazi) interakcije.
- Vezujuče MO imaju nižu energiju od atomskih orbitala koje se kombinuju da bi ih proizvele.
Antivezujuće molekulske orbitale:
- Interakcije protiv vezivanja između atomskih orbitala su destruktivne (van faze) interakcije, sa čvornom ravni gde je talasna funkcija antivezujuće orbitale nula između dva atoma u interakciji
- Antivezujuće MO imaju više energije od atomskih orbitala koje se kombinuju da bi ih proizvele.
Nevezujuće molekulske orbitale:
- Nevezujuće MO su rezultat odsustva interakcije između atomskih orbitala zbog nedostatka kompatibilnih simetrija.
- Nevezujuće MO će imati istu energiju kao atomske orbitale jednog od atoma u molekulu.
Sigma i pi oznake za molekulske orbitale
urediTip interakcije između atomskih orbitala može se dalje kategorizovati oznakama molekulsko-orbitalne simetrije σ (sigma), π (pi), δ (delta), φ (fi), γ (gama) itd. Ovo su korespondirajuća grčka slova na atomske orbitale s, p, d, f i g, respektivno. Broj čvornih ravni koje sadrže međunuklearnu osu između dotičnih atoma je nula za σ MO, jedan za π, dve za δ, tri za φ i četiri za γ.
σ simetrija
urediMolekulska orbitala sa σ simetrijom je rezultat interakcije ili dve atomske s-orbitale ili dve atomske pz-orbitale. Molekulska orbitala će imati σ-simetriju ako je orbitala simetrična u odnosu na osu koja spaja dva nuklearna centra, međunuklearnu osu. To znači da rotacija molekularne orbitale oko međunuklearne ose ne dovodi do promene faze. σ* orbitala, sigma antivezujuća orbitala, takođe održava istu fazu kada se rotira oko internuklearne ose. σ* orbitala ima čvornu ravan koja je između jezgara i okomita je na međunuklearnu osu.[25]
π simetrija
urediMolekulska orbitala sa π simetrijom je rezultat interakcije bilo dve atomske px orbitale ili py orbitale. Molekulska orbitala će imati π simetriju ako je orbitala asimetrična u odnosu na rotaciju oko internuklearne ose. To znači da će rotacija molekulske orbitale oko internuklearne ose dovesti do promene faze. Postoji jedna nodalna ravan koja sadrži međunuklearnu osu, ako se uzmu u obzir stvarne orbitale.
π* orbitala, pi antivezujuća orbitala, takođe će proizvesti promenu faze kada se rotira oko internuklearne ose. π* orbitala takođe ima drugu nodalnu ravan između jezgara.[25][26][27][28]
δ simetrija
urediMolekulska orbitala sa δ simetrijom je rezultat interakcije dve atomske dxy ili dx2-y2 orbitale. Pošto ove molekularne orbitale uključuju niskoenergetske d atomske orbitale, one se vide u kompleksima prelaznih metala. δ vezujuća orbitala ima dve nodalne ravni koje sadrže međunuklearnu osu, a δ* antivezujuća orbitala takođe ima treću nodalnu ravan između jezgara.
φ simetrija
urediTeoretski hemičari su pretpostavili da su veze višeg reda, kao što su fi veze koje odgovaraju preklapanju f atomskih orbitala, moguće. Ne postoji poznati primer molekula za koji se tvrdi da sadrži fi vezu.
Parna i neparna simetrija
urediZa molekule koji poseduju centar inverzije (centrosimetrični molekuli[29][30]) postoje dodatne oznake simetrije koje se mogu primeniti na molekularne orbitale. Centrosimetrični molekuli uključuju:
- Homonuklearni dijatomici, X2
- Oktaedarska, EX6
- Kvadratna ravan, EX4.
Necentrosimetrični molekuli uključuju:
- Heteronuklearni diatomici, XY
- Tetraedri, EX4.
Ako inverzija kroz centar simetrije u molekulu rezultira istim fazama za molekularnu orbitalu, onda se kaže da MO ima džerajd (g) simetriju, od nemačke reči za par. Ako inverzija kroz centar simetrije u molekulu rezultira promenom faze za molekularnu orbitalu, onda se kaže da MO ima andžerejd (u) simetriju, od nemačke reči za neparno.
Za vezujuću molekulsku orbitalu sa σ-simetrijom, orbitala je σg (s' + s'' je simetrična), dok je antivezujuća molekulska orbitala sa σ-simetrijom orbitala σu, jer je inverzija s' – s'' antisimetrična.
Za vezujuću molekulsku orbitalu sa π-simetrijom, orbitala je πu jer bi inverzija kroz centar simetrije proizvela promenu znaka (dve p atomske orbitale su u fazi jedna sa drugom, ali dva režnja imaju suprotne predznake), dok je antivezujuća molekulska orbitala sa π-simetrijom πg jer inverzija kroz centar simetrije ne bi proizvela promenu znaka (dve p orbitale su antisimetrične po fazi).[25]
Molekularno orbitalni dijagrami
urediKvalitativni pristup molekularno orbitalne analize koristi molekularni orbitalni dijagram za vizuelizaciju interakcija vezivanja u molekulu. U ovom tipu dijagrama, molekularne orbitale su predstavljene horizontalnim linijama; što je linija veša to je energija orbitale veća, a degenerisane orbitale se postavljaju na isti nivo sa razmakom između njih. Zatim, elektroni koji se postavljaju u molekularne orbitale se postavljaju jedan po jedan, imajući na umu Paulijev princip isključenja i Hundovo pravilo maksimalnog multipliciteta (samo 2 elektrona, koji imaju suprotne spinove, po orbitali; stavi se što više nesparenih elektrona na jedan nivo energije pre nego što se počne sa uparivanjem). Za komplikovanije molekule, talasno mehanički pristup gubi korisnost u kvalitativnom razumevanju vezivanja (iako je i dalje neophodan za kvantitativni pristup).
Neka svojstva:
- Osnovni skup orbitala uključuje one atomske orbitale koje su dostupne za molekularne orbitalne interakcije, koje mogu biti vezujuće ili antivezujuće
- Broj molekularnih orbitala jednak je broju atomskih orbitala uključenih u linearnu ekspanziju ili bazni skup
- Ako molekul ima neku simetriju, degenerisane atomske orbitale (sa istom atomskom energijom) se grupišu u linearne kombinacije (koje se nazivaju atomske orbitale prilagođene simetriji (engl. symmetry-adapted atomic orbitals (SO))), koje pripadaju reprezentaciji grupe simetrije, te su talasne funkcije koje opisuju grupu poznate kao linearne kombinacije prilagođene simetriji (engl. symmetry-adapted linear combinations, SALC).
- Broj molekularnih orbitala koje pripadaju jednoj grupnoj reprezentaciji jednak je broju atomskih orbitala prilagođenih simetriji koje pripadaju ovoj reprezentaciji
- U okviru određene reprezentacije, atomske orbitale prilagođene simetriji se više mešaju ako su njihovi atomski nivoi energije bliži.
Opšti postupak za konstruisanje molekularnog orbitalnog dijagrama za razumno jednostavan molekul može se sažeti na sledeći način:
- Dodelite tačkastu grupu molekulu.
- Potražite oblike SALC-ova.
- Rasporedite SALC-ove svakog molekularnog fragmenta po energiji, imajući u vidu prvo da li potiču od s, p, ili d orbitala (i stavite ih u redu s < p < d), a zatim po njihovom broju međunuklearnih čvorova.
- Kombinujte SALC-ove istog tipa simetrije iz dva fragmenta i od N SALC-ova formirajte N molekulskih orbitala.
- Procenite relativne energije molekularnih orbitala iz razmatranja preklapanja i relativne energije matičnih orbitala i nacrtajte nivoe na dijagramu nivoa molekularne orbitale (koji pokazuje poreklo orbitala).
- Potvrdite, ispravite i revidirajte ovaj kvalitativni poredak tako što ćete izvršiti proračun molekularne orbite pomoću komercijalnog softvera.[31]
Vezivanje u molekulskim orbitalama
urediOrbitalna degeneracija
urediZa molekularne orbitale se kaže da su degenerisane ako imaju istu energiju. Na primer, u homonuklearnim dvoatomskim molekulima prvih deset elemenata, molekularne orbitale izvedene iz px i the py atomskih orbitala dovode do dve degenerisane orbitale veze (niske energije) i dve degenerisane antivezujuće orbitale (visoke energije).[4]
Jonske veze
urediU jonskoj vezi, suprotno naelektrisani joni su povezani elektrostatičkim privlačenjem.[32] Moguće je opisati jonske veze teorijom molekularne orbite tretirajući ih kao ekstremno polarne veze. Njihove orbitale vezivanja su po energiji veoma bliske atomskim orbitalama anjona. One su takođe po karakteru veoma slične atomskim orbitalama anjona, što znači da su elektroni potpuno pomereni ka anjonu. U kompjuterskim dijagramima, orbitale su centrirane na anjonskom jezgru.[33]
Red veze
urediRed veze, ili broj veza, molekula može se odrediti kombinovanjem broja elektrona u vezujućim i antivezujućim molekularnim orbitalama. Par elektrona u orbitali vezivanja stvara vezu, dok par elektrona u antivezujućoj orbitali negira vezu. Na primer, N2, sa osam elektrona u vezujućim orbitalama i dva elektrona u antivezujućim orbitalama, ima red veze od tri, što čini trostruku vezu.
Jačina veze je proporcionalna redu veze – veća količina vezivanja proizvodi stabilniju vezu – a dužina veze je obrnuto proporcionalna – jača veza je kraća.
Postoje retki izuzeci od zahteva da molekul ima pozitivan red veze. Iako Be2 ima red veze 0 prema molekularno orbitalnoju analizi, postoje eksperimentalni dokazi o veoma nestabilnom molekulu Be2 koji ima dužinu veze od 245 pm i energiju veze od 10 kJ/mol.[25][34]
HOMO i LUMO
urediNajviša popunjena molekulska orbitala se naziva HOMO, a najniža molekulska orbitala koja nije popunjena se naziva LUMO. Razlika između energija HOMO i LUMO molekulskih orbitala se naziva zabranjena zona i može da služi kao mjera za sposobnost pobuđivanja molekula, što je manja energija to je molekul lakše pobuditi.
Nomenklatura molekulskih orbitala
urediPri zapisu molekulskih orbitala navodi se[35]:
- atomske orbitale od kojih potiče molekulska
- broj čvornih ravni (broj nodalnih ravni ili ravni simetrije) preko kvantnog broja λ
- da li je orbitala vezujuća ili razvezujuća
- simetrija orbitala (gerade g (od nemačke reči za parno gerade) ili ungerade u (neparno), u zavisnosti od toga da li je u odnosu na inverziju na centar simetrije orbitala parna ili neparna)
Primeri
urediH2
urediMolekul vodonika se sastoji od dva atoma vodonika koje označavamo sa H' i H". Linearnom kombinacijom 1s' i 1s" atomskih orbitala dobijaju se dve molekulske orbitale: jedna vezivna i druga antivezivna. Vezivna molekulska orbitala se dobije sabiranjem atomskih orbitala i odgovara stanju sistema u kome se elektron nalazi u vezivnoj oblasti. Antivezivna molekulska orbitala se odnosi na oduzimanje atomskih orbitala i odgovara stanju sistema u kome se elektron nalazi u antivezivnoj oblasti.
Vezivna orbitala je po energiji niža od atomskih orbitala, dok antivezivna orbitala ima veću energiju.
Izgradnju molekula od atoma možemo opisati preraspoređivanjem elektrona iz atomskih u molekulske orbitale.
U molekulu vodonika imaju dva elektrona pri čemu oba elektrona se raspoređuju u vezivnu orbitalu pri čemu sistem postaje niži u energiji. Pri tome je napravljena kovalentna veza.
Red veze se definiše kao broj elektrona u vezivnim orbitalama minus broj elektrona u antivezivnim orbitalama i sve podijeljeno sa dva. U primjeru molekula vodonika imaju dva elektrona u vezivnoj orbitali u nema elektrona u antivezivnim orbitalama, pa je red veze jedan i postoji jedna veza između atoma vodonika.
He2
urediHelijum ima dva elektrona u 1s orbitali u osnovnom stanju. U slučaju hipotetičkog molekula He2, dva elektrona bi popunila vezivnu orbitalu a dva antivezivnu i rezultujuća elektronska gustina ne podržava formiranje veze između atoma i molekul ne postoji. Red veze je nula i veza ne postoji.
Da bi mogla da se uspostavi hemijska veza tj. nagradi molekul jedinjenja potrebno je da broj elektrona u vezivnim orbitalama bude veći nego u antivezivnim.
Molekul HeH bi imao malo manju energiju nego početni atomi, ali veću energetsku prednost tj. manju energiju ima H2 + 2 He, tako da molekul HeH postoji samo kratko.
Li2
urediDilitijum Li2 se formira preklapanjem 1s i 2s atomskih orbitala (bazni skup) dva Li atoma. Svaki atom Li doprinosi sa tri elektrona interakcijama vezivanja, a šest elektrona ispunjava tri molekulske orbitale najniže energije, σg(1s), σu*(1s), i σg(2s). Koristeći jednačinu za red veze, utvrđeno je da dilitijum ima red veze od jedan, jednostruke veze.[36]
Plemeniti gasovi
urediUzimajući u obzir hipotetički molekul He2 pošto je osnovni skup atomskih orbitala isti kao u slučaju of H2, nalazi se da su vezujuće i antivezujuće popunjene, tako da nema energetske prednosti za formiranje para. HeH bi imao blagu energetsku prednost, ali ne toliko kao H2 + 2 He, tako da je molekul veoma nestabilan i postoji samo kratko pre nego što se raspadne na vodonik i helijum. Generalno, nalazimo da se atomi kao što je He koji imaju pune energetske ljuske retko vezuju za druge atome. Osim kratkotrajnih Van der Valsovih kompleksa, vrlo je malo jedinjenja plemenitih gasova poznato.[37][38][39][40]
Heteronuklearni diatomici
urediDok molekulske orbitale za homonuklearne dvoatomske molekule sadrže jednake doprinose svake atomske orbitale u interakciji, MO za heteronuklearne diatome sadrže različite atomske orbitalne doprinose. Orbitalne interakcije za produkciju vezivanja ili antivezivanja orbitala u heteronuklearnim diatomicima se dešavaju ako postoji dovoljno preklapanja između atomskih orbitala što je određeno njihovim simetrijama i sličnošću u orbitalnim energijama.
HF
urediU fluorovodoniku HF preklapanje između H 1s i F 2s orbitala je dozvoljeno simetrijom, ali razlika u energiji između dve atomske orbitale sprečava ih da interaguju kako bi se stvorila molekularna orbitala. Preklapanje između H 1s i F 2pz orbitala je takođe simetrijski dozvoljeno, i ove dve atomske orbitale imaju malo energetsko razdvajanje. Stoga, one formiraju interakcije, što dovodi do stvaranja σ i σ* MO i molekula sa redom veze od 1. Pošto je HF necentrosimetričan molekul, oznake simetrije g i u nisu primenljive na njegove molekularne orbitale.[41]
Kvantitativni pristup
urediDa bi se dobile kvantitativne vrednosti za molekularne nivoe energije, potrebno je da postoje molekularne orbitale koje su takve da ekspanzija konfiguracione interakcije[42][43] brzo konvergira ka limitu pune konfiguracione interakcije.[44][45] Najčešći metod za dobijanje takvih funkcija je Hartri–Fokov metod, koji izražava molekularne orbitale kao sopstvene funkcije Fokovog operatora. Obično se ovaj problem rešava proširenjem molekularnih orbitala kao linearnih kombinacija Gausovih funkcija centriranih na atomskim jezgrima (vidi linearnu kombinaciju atomskih orbitala i hemijski bazni set[46][47][48]). Jednačine za koeficijente ovih linearnih kombinacija su generalizovane jednačine sopstvenih vrednosti poznate kao Rutanove jednačine,[49][50][51] koje su zapravo poseban prikaz Hartri–Fokove jednačine. Postoji veliki broj programa u kojima se mogu izvršiti kvantno hemijski proračuni MO, uključujući Spartan.[52][53][54][55][56][57]
Jednostavni proračuni često sugerišu da se eksperimentalne molekularne orbitalne energije mogu dobiti metodama ultraljubičaste fotoelektronske spektroskopije za valentne orbitale i rendgenske fotoelektronske spektroskopije za sržne orbitale. Ovo, međutim, nije tačno jer ovi eksperimenti mere energiju jonizacije, razliku u energiji između molekula i jednog od jona, koja je rezultat uklanjanja jednog elektrona. Energije jonizacije su približno povezane sa orbitalnim energijama Kupmansovom teoremom.[58][59][60][61][62] Dok saglasnost između ove dve vrednosti može biti bliska za neke molekule, u drugim slučajevima može biti veoma loša.
Energetski dijagrami
urediU slučaju složenijih molekula, talasno mehanički model je pogodan za kvantitivni opis veza, ali ne i za kvalitativni. Zbog toga se uvode energetski dijagrami u kojima se molekulske orbitale predstavljene horizontalnim linijama, pri čemu orbitale koje imaju višu energiju su nacrtane više. Degenerisane orbitale (orbitale sa istom energijom) su predstavljene na istom nivou, ali se između njih nalazi razmak. Elektroni se popunjavaju jedan po jedan pridržavajući se Paulijevog principa isključenja i Hundovog pravila tj. u jednoj orbitali se nalaze maksimalno dva elektrona suprotnog spina, na istom energetskom nivou elektroni se popunjavaju da ima maksimalan broj nesparenih elektrona a zatim se uparuju.
Vidi još
urediNapomene
urediReference
uredi- ^ Peter Atkins; Julio De Paula. Atkins’ Physical Chemistry. Oxford University Press. 8th ed., 2006.}-
- ^ Yves Jean; Francois Volatron. An Introduction to Molecular Orbitals. Oxford University Press, 1993.
- ^ Munowitz 2000, str. 229–233
- ^ a b v Miessler, G.L.; Tarr, Donald A. (2008). Inorganic Chemistry. Pearson Education. ISBN 978-81-317-1885-8.
- ^ Mulliken, Robert S. (jul 1932). „Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations”. Physical Review. 41 (1): 49—71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ^ orbital. Dictionary by Merriam-Webster: America's most-trusted online dictionary. Merriam-Webster. Pristupljeno 18. 4. 2021.
- ^ a b Mulliken, Robert S. (jul 1932). „Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations”. Physical Review. 41 (1): 49—71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
- ^ Brown, Theodore (2002). Chemistry : the central science. Upper Saddle River, NJ: Prentice Hall. ISBN 0-13-066997-0.
- ^ Cotton, F. Albert (1990). Chemical applications of group theory (3rd izd.). New York: Wiley. str. 102. ISBN 0471510947. OCLC 19975337.
- ^ Murrell, J. N.; Kettle, S. F. A.; Tedder, J. M. (1985). The Chemical Bond (2nd izd.). John Wiley & Sons. ISBN 0-471-90759-6.
- ^ Bury, Charles R. (jul 1921). „Langmuir's Theory of the Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society (na jeziku: engleski). 43 (7): 1602—1609. ISSN 0002-7863. doi:10.1021/ja01440a023.
- ^ Hirst, D. M.; Linington, Mary E. (1970). „Localized orbitals for the oxygen and nitric oxide molecules”. Theoretica Chimica Acta. 16 (1): 55—62. S2CID 95235964. doi:10.1007/BF01045967.
- ^ Duke, Brian J. (1987). „Linnett's double quartet theory and localised orbitals”. Journal of Molecular Structure: THEOCHEM. 152 (3–4): 319—330. doi:10.1016/0166-1280(87)80072-6.
- ^ Jensen, Frank (2007). Introduction to Computational Chemistry . Chichester, England: John Wiley and Sons. str. 304–308. ISBN 978-0-470-01187-4.
- ^ Albright, T. A.; Burdett, J. K.; Whangbo, M.-H. (2013). Orbital Interactions in Chemistry. Hoboken, N.J.: Wiley. ISBN 9780471080398.
- ^ Hund, F. (1926). „Zur Deutung einiger Erscheinungen in den Molekelspektren” [On the interpretation of some phenomena in molecular spectra]. Zeitschrift für Physik (na jeziku: nemački). Springer Science and Business Media LLC. 36 (9–10): 657—674. Bibcode:1926ZPhy...36..657H. ISSN 1434-6001. S2CID 123208730. doi:10.1007/bf01400155.
- ^ F. Hund, "Zur Deutung der Molekelspektren", Zeitschrift für Physik, Part I, vol. 40, pages 742-764 (1927); Part II, vol. 42, pages 93–120 (1927); Part III, vol. 43, pages 805-826 (1927); Part IV, vol. 51, pages 759-795 (1928); Part V, vol. 63, pages 719-751 (1930).
- ^ Mulliken, Robert S. (1. 5. 1927). „Electronic States and Band Spectrum Structure in Diatomic Molecules. IV. Hund's Theory; Second Positive Nitrogen and Swan Bands; Alternating Intensities”. Physical Review. American Physical Society (APS). 29 (5): 637—649. Bibcode:1927PhRv...29..637M. ISSN 0031-899X. doi:10.1103/physrev.29.637.
- ^ Mulliken, Robert S. (1928). „The assignment of quantum numbers for electrons in molecules. Extracts from Phys. Rev. 32, 186-222 (1928), plus currently written annotations”. International Journal of Quantum Chemistry. Wiley. 1 (1): 103—117. ISSN 0020-7608. doi:10.1002/qua.560010106.
- ^ Friedrich Hund and Chemistry, Werner Kutzelnigg, on the occasion of Hund's 100th birthday, Angewandte Chemie International Edition, 35, 573–586, (1996)
- ^ Robert S. Mulliken's Nobel Lecture, Science, 157, no. 3785, 13-24. Available on-line at: Nobelprize.org
- ^ Huheey, James. Inorganic Chemistry:Principles of Structure and Reactivity
- ^ Mulliken, Robert S. (1967-07-07). „Spectroscopy, Molecular Orbitals, and Chemical Bonding”. Science. American Association for the Advancement of Science (AAAS). 157 (3784): 13—24. Bibcode:1967Sci...157...13M. ISSN 0036-8075. PMID 5338306. doi:10.1126/science.157.3784.13.
- ^ Lennard-Jones, John (Sir) (1929). „The electronic structure of some diatomic molecules”. Transactions of the Faraday Society. 25: 668—686. Bibcode:1929FaTr...25..668L. doi:10.1039/tf9292500668.
- ^ a b v g Catherine E. Housecroft, Alan G. Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, p. 29-33.
- ^ Peter Atkins; Julio De Paula (2006). Atkins’ Physical Chemistry (8th izd.). Oxford University Press.
- ^ Yves Jean; François Volatron (1993). An Introduction to Molecular Orbitals. Oxford University Press.
- ^ Michael Munowitz (2000). Principles of Chemistry. Norton & Company. str. 229—233.
- ^ Fu, Liang; Kane, C. (2007). „Topological insulators with inversion symmetry”. Physical Review B. 76 (4): 045302. Bibcode:2007PhRvB..76d5302F. S2CID 15011491. arXiv:cond-mat/0611341 . doi:10.1103/PhysRevB.76.045302.
- ^ Cockcroft, Jeremy Karl. „The 230 3-Dimensional Space Groups”. Birkbeck College, University of London. Pristupljeno 18. 8. 2014.
- ^ Atkins, Peter; et al. (2006). Inorganic chemistry (4. izd.). New York: W.H. Freeman. str. 208. ISBN 978-0-7167-4878-6.
- ^ „Ionic bond”. IUPAC Compendium of Chemical Terminology. 2009. ISBN 978-0-9678550-9-7. doi:10.1351/goldbook.IT07058.
- ^ „5.3.3: Ionic Compounds and Molecular Orbitals”. Chemistry LibreTexts (na jeziku: engleski). 2020-08-06. Pristupljeno 2024-06-06.
- ^ Bondybey, V.E. (1984). „Electronic structure and bonding of Be2”. Chemical Physics Letters. 109 (5): 436—441. Bibcode:1984CPL...109..436B. doi:10.1016/0009-2614(84)80339-5.
- ^ Belić 2000, str. 101.
- ^ König, Burkhard (1995). „Chemical Bonding”. Angewandte Chemie (na jeziku: nemački). 107 (4): 540. Bibcode:1995AngCh.107..540K. doi:10.1002/ange.19951070434.
- ^ Smith GL, Mercier HP, Schrobilgen GJ (februar 2007). „Synthesis of [F3S≡NXeF][AsF6] and structural study by multi-NMR and Raman spectroscopy, electronic structure calculations, and X-ray crystallography”. Inorganic Chemistry. 46 (4): 1369—78. PMID 17256847. doi:10.1021/ic061899+.
- ^ Smith GL, Mercier HP, Schrobilgen GJ (maj 2008). „F5SN(H)Xe+; a rare example of xenon bonded to sp3-hybridized nitrogen; synthesis and structural characterization of [F5SN(H)Xe][AsF6]”. Inorganic Chemistry. 47 (10): 4173—84. PMID 18407626. doi:10.1021/ic702039f.
- ^ Pauling, Linus (jun 1933). „The Formulas of Antimonic Acid and the Antimonates”. J. Am. Chem. Soc. 55 (5): 1895—1900. doi:10.1021/ja01332a016.
- ^ Holloway, John H. (1968). Noble-Gas Chemistry. London: Methuen. ISBN 0-416-03270-2.
- ^ Catherine E. Housecroft, Alan G, Sharpe, Inorganic Chemistry, Pearson Prentice Hall; 2nd Edition, 2005, ISBN 0130-39913-2, p. 41-43.
- ^ Cramer, Christopher J. (2002). Essentials of Computational Chemistry. Chichester: John Wiley & Sons, Ltd. str. 191–232. ISBN 0-471-48552-7.
- ^ Sherrill, C. David; Schaefer III, Henry F. (1999). Löwdin, Per-Olov, ur. The Configuration Interaction Method: Advances in Highly Correlated Approaches. Advances in Quantum Chemistry. 34. San Diego: Academic Press. str. 143—269. Bibcode:1999AdQC...34..143S. ISBN 0-12-034834-9. doi:10.1016/S0065-3276(08)60532-8.
- ^ Ross, I. G. (1952). „Calculations of the energy levels of acetylene by the method of antisymmetric molecular orbitals, including σ-π interaction”. Transactions of the Faraday Society. The Royal Society of Chemistry. 48: 973—991. doi:10.1039/TF9524800973.
- ^ Foresman, James B.; Æleen Frisch (1996). Exploring Chemistry with Electronic Structure Methods (2nd izd.). Pittsburgh, PA: Gaussian Inc. str. 266, 278–283. ISBN 0-9636769-3-8.
- ^ Lehtola, Susi (2019). „A review on non-relativistic fully numerical electronic structure calculations on atoms and diatomic molecules”. Int. J. Quantum Chem. 119 (19): e25968. arXiv:1902.01431 . doi:10.1002/qua.25968 .
- ^ Errol G. Lewars (2003-01-01). Computational Chemistry: Introduction to the Theory and Applications of Molecular and Quantum Mechanics (1st izd.). Springer. ISBN 978-1402072857.
- ^ Jensen, Frank (2013). „Atomic orbital basis sets”. WIREs Comput. Mol. Sci. 3 (3): 273—295. S2CID 124142343. doi:10.1002/wcms.1123.
- ^ Frank Jensen (1999). Introduction to Computational Chemistry. str. 65—69,. ISBN 0-471-98085-4.. John Wiley and Sons.
- ^ Roothaan, C. C. J. (1951). „New Developments in Molecular Orbital Theory”. Reviews of Modern Physics. 23 (2): 69—89. Bibcode:1951RvMP...23...69R. doi:10.1103/RevModPhys.23.69.
- ^ Hall, G. G. (1951). „The Molecular Orbital Theory of Chemical Valency. VIII. A Method of Calculating Ionization Potentials”. Proceedings of the Royal Society A. 205 (1083): 541—552. Bibcode:1951RSPSA.205..541H. S2CID 94393143. doi:10.1098/rspa.1951.0048.
- ^ Hehre, Warren J.; Leo Radom; Paul v.R. Schleyer; John A. Pople (1986). Ab initio molecular orbital theory. John Wiley & Sons. ISBN 0-471-81241-2.
- ^ Hohenberg, Pierre; Walter Kohn (1964). „Inhomogeneous electron gas”. Physical Review. 136 (3B): B864—B871. Bibcode:1964PhRv..136..864H. doi:10.1103/PhysRev.136.B864 .
- ^ Cramer, Christopher J. (2002). Essentials of Computational Chemistry. John Wiley & Sons. ISBN 978-0-470-09182-1.
- ^ Larry A. Curtiss; Paul C. Redfern; Krishnan Raghavachari; Vitaly Rassolov; John A. Pople (1998). „Gaussian-3 theory using reduced Møller-Plesset order”. The Journal of Chemical Physics. The American Institute of Physics. 110 (10): 4703—4710. Bibcode:1999JChPh.110.4703C. doi:10.1063/1.478385.
- ^ Ohlinger, William S.; Philip E. Klunzinger; Bernard J. Deppmeier; Warren J. Hehre (2009). „Efficient Calculation of Heats of Formation”. The Journal of Physical Chemistry A. ACS Publications. 113 (10): 2165—2175. Bibcode:2009JPCA..113.2165O. PMID 19222177. doi:10.1021/jp810144q.
- ^ Krylov, Anna I.; Gill, Peter M.W. (2013). „Q-Chem: an engine for innovation”. Wiley Interdisciplinary Reviews: Computational Molecular Science. 3 (3): 317—326. S2CID 16713704. doi:10.1002/wcms.1122.
- ^ Koopmans, Tjalling (1934). „Über die Zuordnung von Wellenfunktionen und Eigenwerten zu den einzelnen Elektronen eines Atoms”. Physica. 1 (1–6): 104—113. Bibcode:1934Phy.....1..104K. doi:10.1016/S0031-8914(34)90011-2.
- ^ Szabo, Attila; Ostlund, Neil S. (1996). Modern quantum chemistry. Dover Publications. str. 128. ISBN 0-486-69186-1. OCLC 34357385.
- ^ Politzer, Peter; Abu-Awwad, Fakher (1998). „A comparative analysis of Hartree–Fock and Kohn–Sham orbital energies”. Theoretical Chemistry Accounts: Theory, Computation, and Modeling. 99 (2): 83—87. S2CID 96583645. doi:10.1007/s002140050307.
- ^ Hamel, Sebastien; Duffy, Patrick; Casida, Mark E.; Salahub, Dennis R. (2002). „Kohn–Sham orbitals and orbital energies: fictitious constructs but good approximations all the same”. Journal of Electron Spectroscopy and Related Phenomena. 123 (2–3): 345—363. doi:10.1016/S0368-2048(02)00032-4.
- ^ See, for example, Szabo, A.; Ostlund, N. S. (1982). „Chapter 3”. Modern Quantum Chemistry. ISBN 978-0-02-949710-4.
Literatura
uredi- Munowitz, Michael (2000). Principles of Chemistry. Norton & Company. str. 229-233.
- Belić, Dragoljub (2000). Fizika molekula. Beograd. str. 101.
- Cohen-Tannoudji, Claude; Diu, Bernard; Laloë, Franck. Quantum Mechanics. 1. Hermann. ISBN 9782705683924.
- Shankar, Ramamurti (2013). Principles of Quantum Mechanics. Springer. ISBN 9781461576754.
- Larson, Ron; Falvo, David C. (30. 3. 2009). Elementary Linear Algebra, Enhanced Edition. Cengage Learning. str. 8—. ISBN 978-1-305-17240-1.
- Hobson; Kenneth Franklin, Riley; Bence, Stephen John. Mathematical Methods For Physics And Engineering (Clpe) (2nd izd.). Cambridge University Press. ISBN 978-0-521-61296-8.
- Hemmer, Per Christian (2005). Kvantemekanikk: P.C. Hemmer. Tapir akademisk forlag. Tillegg 3: supplement to sections 3.1, 3.3, and 3.5. ISBN 978-82-519-2028-5.
- Quantum degeneracy in two dimensional systems, Debnarayan Jana, Dept. of Physics, University College of Science and Technology
- Al-Hashimi, Munir (2008). Accidental Symmetry in Quantum Physics.
- Orchin, M. Jaffe, H.H. (1967) The Importance of Antibonding Orbitals. Houghton Mifflin. ISBN B0006BPT5O
- Thomas A. Halgren (1996). „Merck molecular force field. I. Basis, form, scope, parameterization, and performance of MMFF94”. Journal of Computational Chemistry. 17 (5–6): 490—519. doi:10.1002/(SICI)1096-987X(199604)17:5/6<490::AID-JCC1>3.0.CO;2-P.
- Matthew Clark; Richard D. Cramer III; Nicole Van Opdenbosch (1989). „Validation of the general purpose tripos 5.2 force field”. Journal of Computational Chemistry. 10 (8): 982—1012. S2CID 97743988. doi:10.1002/jcc.540100804.
- Michael J. S. Dewar; Walter Thiel (1977). „Ground states of molecules. 38. The MNDO method. Approximations and parameters”. Journal of the American Chemical Society. ACS Publications. 99 (15): 4899—4907. doi:10.1021/ja00457a004.
- Michael J. S. Dewar; Eve G. Zoebisch; Eamonn F. Healy; James J. P. Stewart (1985). „Development and use of quantum molecular models. 75. Comparative tests of theoretical procedures for studying chemical reactions”. Journal of the American Chemical Society. ACS Publications. 107 (13): 3902—3909. doi:10.1021/ja00299a024.
- James J. P. Stewart (1989). „Optimization of parameters for semiempirical methods I. Method”. The Journal of Computational Chemistry. 10 (2): 209—220. S2CID 36907984. doi:10.1002/jcc.540100208.
- James J. P. Stewart (1989). „Optimization of parameters for semiempirical methods II. Applications”. The Journal of Computational Chemistry. 10 (2): 221—264. S2CID 98850840. doi:10.1002/jcc.540100209.
- James J. P. Stewart (1991). „Optimization of parameters for semiempirical methods. III Extension of PM3 to Be, Mg, Zn, Ga, Ge, As, Se, Cd, In, Sn, Sb, Te, Hg, Tl, Pb, and Bi”. The Journal of Computational Chemistry. 12 (3): 320—341. S2CID 94913344. doi:10.1002/jcc.540120306.
- James J. P. Stewart (2004). „Optimization of parameters for semiempirical methods IV: extension of MNDO, AM1, and PM3 to more main group elements”. The Journal of Molecular Modeling. Springer Berlin-Heidelberg. 10 (2): 155—164. PMID 14997367. S2CID 11617476. doi:10.1007/s00894-004-0183-z.
- Gerd B. Rocha; Ricardo O. Freire; Alfredo M. Simas; James J. P. Stewart (2006). „RM1: A reparameterization of AM1 for H, C, N, O, P, S, F, Cl, Br, and I”. The Journal of Computational Chemistry. 27 (10): 1101—1111. PMID 16691568. S2CID 9017673. doi:10.1002/jcc.20425.
- James J. P. Stewart (2007). „Optimization of Parameters for Semiempirical Methods V: Modification of NDDO Approximations and Application to 70 Elements”. The Journal of Molecular Modeling. Springer. 13 (12): 1173—1213. PMC 2039871 . PMID 17828561. doi:10.1007/s00894-007-0233-4.
- Aleksandr V. Marenich; Ryan M. Olson; Casey P. Kelly; Christopher J. Cramer; Donald G. Truhlar (2007). „Self-Consistent Reaction Field Model for Aqueous and Nonaqueous Solutions Based on Accurate Polarized Partial Charges”. Journal of Chemical Theory and Computation. ACS Publications. 3 (6): 2011—2033. PMID 26636198. doi:10.1021/ct7001418.
- A. D. Becke (1988). „Density-functional exchange-energy approximation with correct asymptotic behavior”. Physical Review A. American Physical Society. 38 (6): 3098—3100. Bibcode:1988PhRvA..38.3098B. PMID 9900728. doi:10.1103/PhysRevA.38.3098.
- John P. Perdew (1986). „Density-functional approximation for the correlation energy of the inhomogeneous electron gas”. Physical Review B. American Physical Society. 33 (12): 8822—8824. Bibcode:1986PhRvB..33.8822P. PMID 9938299. doi:10.1103/PhysRevB.33.8822.
- Lee, Chengeth; Weitao Yang; Robert G. Parr (1988). „Development of the Colle-Salvetti correlation-energy formula into a functional of the electron density”. Physical Review B. American Physical Society. 37 (2): 785—789. Bibcode:1988PhRvB..37..785L. PMID 9944570. doi:10.1103/PhysRevB.37.785.
- P. J. Stephens; F. J. Devlin; C. F. Chabalowski; M. J. Frisch (1994). „Ab Initio Calculation of Vibrational Absorption and Circular Dichroism Spectra Using Density Functional Force Fields”. The Journal of Physical Chemistry. ACS Publications. 98 (45): 11623—11627. S2CID 97035345. doi:10.1021/j100096a001.
- Ross D. Adamsona, Peter M. W. Gill and John A. Pople (1998). „Empirical density functionals”. Chemical Physics Letters. Elsevier. 284 (5–6): 6—11. Bibcode:1998CPL...284....6A. doi:10.1016/S0009-2614(97)01282-7.
- Peter M. W. Gill, Yeh Lin Ching and Michael W. George (2004). „EDF2: A density functional for predicting molecular vibrational frequencies”. Australian Journal of Chemistry. Commonwealth Scientific and Industrial Research Organization. 57 (4): 365—370. doi:10.1071/CH03263.
- Yan Zhao; Donald G. Truhlar (2008). „The M06 suite of density functionals for main group thermochemistry, thermochemical kinetics, noncovalent interactions, excited states, and transition elements: two new functionals and systematic testing of four M06-class functionals and 12 other functionals”. Theoretical Chemistry Accounts. Springer Berlin / Heidelberg. 120 (1–3): 215—241. doi:10.1007/s00214-007-0310-x .
- J. D. Chai; Martin Head-Gordon (2008). „Long-range corrected hybrid density functionals with damped atom-atom dispersion corrections”. Physical Chemistry Chemical Physics. RSC Publishing. 10 (44): 6615—66120. Bibcode:2008PCCP...10.6615C. PMID 18989472. S2CID 32301575. doi:10.1039/b810189b.
- P.A.M. Dirac (1930). „Note on Exchange Phenomena in the Thomas Atom”. Mathematical Proceedings of the Cambridge Philosophical Society. Cambridge Journals. 26 (3): 376—385. Bibcode:1930PCPS...26..376D. doi:10.1017/S0305004100016108 .
- Peter M. W. Gill (1996). „A new gradient-corrected exchange functional”. Molecular Physics. Taylor & Francis. 89 (2): 433—445. Bibcode:1996MolPh..89..433G. doi:10.1080/00268979609482484.
- A.T.B. Gilbert; P.M.W. Gill (1999). „Decomposition of exchange-correlation energies”. Chemical Physics Letters. Elsevier. 312 (5–6): 511—521. Bibcode:1999CPL...312..511G. doi:10.1016/S0009-2614(99)00836-2.
- John P. Perdew; Yue Wang (1992). „Accurate and simple analytic representation of the electron-gas correlation energy”. Physical Review B. American Physical Society. 45 (23): 13244—13249. Bibcode:1992PhRvB..4513244P. PMID 10001404. doi:10.1103/PhysRevB.45.13244.
- Vosko, S.H.; Wilk, L.; Nusair, M. (1980). „Accurate spin-dependent electron liquid correlation energies for local spin density calculations: a critical analysis” (PDF). Canadian Journal of Physics. NRC Research Press. 58 (8): 1200—1211. Bibcode:1980CaJPh..58.1200V. S2CID 122287164. doi:10.1139/p80-159.
- John P. Perdew; Yue Wang (1992). „Accurate and simple analytic representation of the electron-gas correlation energy”. Physical Review B. The American Physical Society. 45 (23): 13244—13249. Bibcode:1992PhRvB..4513244P. PMID 10001404. doi:10.1103/PhysRevB.45.13244.
- J. P. Perdew (1981). „Density-functional approximation for the correlation energy of the inhomogeneous electron gas”. Physical Review B. The American Physical Society. 23 (10): 5048—5079. Bibcode:1981PhRvB..23.5048P. doi:10.1103/PhysRevB.23.5048 .
- J. P. Perdew; A. Zunger (1986). „Self-interaction correction to density-functional approximations for many-electron systems”. Physical Review B. The American Physical Society. 33 (12): 8822—8824. Bibcode:1986PhRvB..33.8822P. PMID 9938299. doi:10.1103/PhysRevB.33.8822.
- John P. Perdew; Kieron Burke; Matthias Ernzerhof (1996). „Generalized Gradient Approximation Made Simple”. Physical Review Letters. American Physical Society. 77 (18): 3865—3868. Bibcode:1996PhRvL..77.3865P. PMID 10062328. S2CID 6425905. doi:10.1103/PhysRevLett.77.3865.
- A. D. Becke; M. R. Roussel (1989). „Exchange holes in inhomogeneous systems: A coordinate-space model”. Physical Review A. The American Physical Society. 39 (8): 3761—3767. Bibcode:1989PhRvA..39.3761B. PMID 9901696. doi:10.1103/PhysRevA.39.3761.
- A. Daniel Boese; Jan M. L. Martin (2004). „Development of density functionals for thermochemical kinetics”. The Journal of Chemical Physics. 121 (8): 3405—3417. Bibcode:2004JChPh.121.3405B. PMID 15303903. S2CID 29764068. arXiv:physics/0405158 . doi:10.1063/1.1774975.
- Yan Zhao; Nathan E. Schultz; Donald G. Truhlar (2006). „Design of Density Functionals by Combining the Method of Constraint Satisfaction with Parameterization for Thermochemistry, Thermochemical Kinetics, and Noncovalent Interactions”. Journal of Chemical Theory and Computation. ACS Publications. 2 (2): 364—382. PMID 26626525. doi:10.1021/ct0502763.
- Yan Zhao; Donald G. Truhlar (2008). „A new local density functional for main-group thermochemistry, transition metal bonding, thermochemical kinetics, and noncovalent interactions”. The Journal of Chemical Physics. American Institute of Physics. 125 (19): 194101—194119. Bibcode:2006JChPh.125s4101Z. PMID 17129083. doi:10.1063/1.2370993.
- Yan Zhao; Donald G. Truhlar (2008). „Density Functional for Spectroscopy: No Long-Range Self-Interaction Error, Good Performance for Rydberg and Charge-Transfer States, and Better Performance on Average than B3LYP for Ground States”. The Journal of Physical Chemistry A. ACS Publications. 110 (49): 13126—13130. Bibcode:2006JPCA..11013126Z. PMID 17149824. doi:10.1021/jp066479k.
- Jeng-Da Chai; Martin Head-Gordon (2006). „Systematic optimization of long-range corrected hybrid density functionals” (PDF). The Journal of Chemical Physics. American Institute of Physics. 128 (8): 084106—084121. Bibcode:2008JChPh.128h4106C. PMID 18315032. doi:10.1063/1.2834918. Arhivirano iz originala (PDF) 12. 10. 2023. g. Pristupljeno 25. 09. 2024.
- George D. Purvis; Rodney J. Bartlett (1982). „A full coupled-cluster singles and doubles model: The inclusion of disconnected triples”. The Journal of Chemical Physics. The American Institute of Physics. 76 (4): 1910—1919. Bibcode:1982JChPh..76.1910P. doi:10.1063/1.443164.
- Krishnan Raghavachari; Gary W. Trucks; John A. Pople and; Martin Head-Gordon (1989). „A fifth-order perturbation comparison of electron correlation theories”. Chemical Physics Letters. Elsevier Science. 157 (6): 479—483. Bibcode:1989CPL...157..479R. doi:10.1016/S0009-2614(89)87395-6.
- Troy Van Voorhis; Martin Head-Gordon (2001). „Two-body coupled cluster expansions”. The Journal of Chemical Physics. The American Institute of Physics. 115 (11): 5033—5041. Bibcode:2001JChPh.115.5033V. doi:10.1063/1.1390516.
- C. David Sherrill; Anna I. Krylov; Edward F. C. Byrd; Martin Head-Gordon (1998). „Energies and analytic gradients for a coupled-cluster doubles model using variational Brueckner orbitals: Application to symmetry breaking in O+
4”. The Journal of Chemical Physics. The American Institute of Physics. 109 (11): 4171—4182. Bibcode:1998JChPh.109.4171S. doi:10.1063/1.477023. - Steven R. Gwaltney; Martin Head-Gordon (2000). „A second-order correction to singles and doubles coupled-cluster methods based on a perturbative expansion of a similarity-transformed Hamiltonian”. Chemical Physics Letters. Elsevier. 323 (1–2): 21—28. Bibcode:2000CPL...323...21G. doi:10.1016/S0009-2614(00)00423-1.
- Troy Van Voorhis; Martin Head-Gordon (2000). „The quadratic coupled cluster doubles model”. Chemical Physics Letters. Elsevier. 330 (5–6): 585—594. Bibcode:2000CPL...330..585V. doi:10.1016/S0009-2614(00)01137-4.
- Anna I. Krylov; C. David Sherrill; Edward F. C. Byrd; Martin Head-Gordon (1998). „Size-consistent wave functions for nondynamical correlation energy: The valence active space optimized orbital coupled-cluster doubles model”. The Journal of Chemical Physics. The American Institute of Physics. 109 (24): 10669—10678. Bibcode:1998JChPh.10910669K. doi:10.1063/1.477764.
- Chr. Møller; M. S. Plesset (1934). „Note on an Approximation Treatment form Many-Electron Systems” (PDF). Physical Review. The American Physical Society. 46 (7): 618—622. Bibcode:1934PhRv...46..618M. doi:10.1103/PhysRev.46.618.
- Head-Gordon, Martin; Pople, John A.; Frisch, Michael J. (1988). „MP2 energy evaluation by direct methods”. Chemical Physics Letters. 153 (6): 503—506. Bibcode:1988CPL...153..503H. doi:10.1016/0009-2614(88)85250-3.
- Pople, J. A.; Seeger, R.; Krishnan, R. (1977). „Variational configuration interaction methods and comparison with perturbation theory”. International Journal of Quantum Chemistry. 12 (S11): 149—163. doi:10.1002/qua.560120820.
- Pople, John A.; Binkley, J. Stephen; Seeger, Rolf (1976). „Theoretical models incorporating electron correlation”. International Journal of Quantum Chemistry. 10 (S10): 1—19. doi:10.1002/qua.560100802.
- Krishnan Raghavachari; John A. Pople (1978). „Approximate fourth-order perturbation theory of the electron correlation energy”. International Journal of Quantum Chemistry. 14 (1): 91—100. doi:10.1002/qua.560140109.
- Martin Feyereisena, George Fitzgeralda; Andrew Komornickib (1993). „Scaled Second-Order Perturbation Corrections to Configuration Interaction Singles: Efficient and Reliable Excitation Energy Methods”. Chemical Physics Letters. Elsevier. 208 (5–6): 359—363. Bibcode:1993CPL...208..359F. doi:10.1016/0009-2614(93)87156-W.
- Florian Weigend; Marco Häser (1997). „RI-MP2: first derivatives and global consistency”. Theoretical Chemistry Accounts. Springer Berlin / Heidelberg. 97 (1–4): 331—340. S2CID 97649855. doi:10.1007/s002140050269.
- Robert A. Distasio J.R.; Ryan P. Steele; Young Min Rhee; Yihan Shao; Martin Head-Gordon (2007). „An improved algorithm for analytical gradient evaluation in resolution-of-the-identity second-order Møller-Plesset perturbation theory: Application to alanine tetrapeptide conformational analysis”. Journal of Computational Chemistry. 28 (5): 839—856. PMID 17219361. S2CID 8438511. doi:10.1002/jcc.20604.
- Erich Runge; E. K. U. Gross (1984). „Density-Functional Theory for Time-Dependent Systems”. Physical Review Letters. American Physical Society. 52 (12): 997—1000. Bibcode:1984PhRvL..52..997R. doi:10.1103/PhysRevLett.52.997.
- So Hirata; Martin Head-Gordon (1999). „Time-dependent density functional theory for radicals: An improved description of excited states with substantial double excitation character”. Chemical Physics Letters. Elsevier. 302 (5–6): 375—382. Bibcode:1999CPL...302..375H. doi:10.1016/S0009-2614(99)00137-2.
- David Maurice; Martin Head-Gordon (1999). „Analytical second derivatives for excited electronic states using the single excitation configuration interaction method: theory and application to benzo[a]pyrene and chalcone”. Molecular Physics. Taylor & Francis. 96 (10): 1533—1541. Bibcode:1999MolPh..96.1533M. doi:10.1080/00268979909483096.
- Martin Head-Gordon; Rudolph J. Rico; Manabu Oumi; Timothy J. Lee (1994). „A doubles correction to electronic excited states from configuration interaction in the space of single substitutions”. Chemical Physics Letters. Elsevier. 219 (1–2): 21—29. Bibcode:1994CPL...219...21H. doi:10.1016/0009-2614(94)00070-0.
- John A. Pople; Martin Head-Gordon; Krishnan Raghavachari (1987). „Quadratic configuration interaction. A general technique for determining electron correlation energies”. The Journal of Chemical Physics. American Institute of Physics. 87 (10): 5968—35975. Bibcode:1987JChPh..87.5968P. doi:10.1063/1.453520.
- Rhee, Young Min; Martin Head-Gordon (2007). „Scaled Second-Order Perturbation Corrections to Configuration Interaction Singles: Efficient and Reliable Excitation Energy Methods”. The Journal of Physical Chemistry A. ACS Publications. 111 (24): 5314—5326. Bibcode:2007JPCA..111.5314R. PMID 17521172. S2CID 20103672. doi:10.1021/jp068409j.
- Larry A. Curtiss; Krishnan Raghavachari; Gary W. Trucks; John A. Pople (1991). „Gaussian-2 theory for molecular energies of first- and second-row compounds”. The Journal of Chemical Physics. The American Institute of Physics. 94 (11): 7221—7231. Bibcode:1991JChPh..94.7221C. doi:10.1063/1.460205 .
- Larry A. Curtiss; Krishnan Raghavachari; Paul C. Redfern; Vitaly Rassolov; John A. Pople (1998). „Gaussian-3 (G3) theory for molecules containing first and second-row atoms”. The Journal of Chemical Physics. The American Institute of Physics. 109 (18): 7764—7776. Bibcode:1998JChPh.109.7764C. doi:10.1063/1.477422.
Spoljašnje veze
uredi- Java molecular orbital viewer shows orbitals of hydrogen molecular ion.
- The orbitron, a visualization of all atomic, and some molecular and hybrid orbitals
- xeo Visualizations of some atomic and molecular atoms