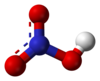
Azotna kiselina
Azotna kiselina je veoma jaka neorganska kiselina molekulske formule HNO3. To je bezbojna, izuzetno kaustična i otrovna supstanca. Lako isparava, a pri koncentracijama većim od 86% često se naziva pušljiva azotna kiselina. U koncentrovanom obliku izuzetno je jako oksidaciono sredstvo. Prvi ju je sintetisao alhemičar Jabir ibn Hajan oko 9. veka nove ere. Soli ove kiseline nazivaju se nitrati.
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Azotna kiselina
| |||
| Drugi nazivi
Aqua fortis, Eau forte, vodnik nitrat, Acidum nitricum
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| 3DMet | B00068 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.832 | ||
| EC broj | 231-714-2 | ||
| Gmelin Referenca | 1576 | ||
| KEGG[1] | |||
| MeSH | Nitric+acid | ||
| RTECS | QU5775000 | ||
| UNII | |||
| UN broj | 2031 | ||
| |||
| |||
| Svojstva | |||
| HNO3 | |||
| Molarna masa | 63,01 g·mol−1 | ||
| Agregatno stanje | Bezbojna, žuta ili crvena dimuća tečnost[4] | ||
| Miris | oštar, gušeći[4] | ||
| Gustina | 1,51 g cm−3, 1,41 g cm−3 [68% w/w] | ||
| Tačka topljenja | −42 °C (−44 °F; 231 K) | ||
| Tačka ključanja | 83 °C (181 °F; 356 K) 68% rastvor ključa na 121 °C | ||
| Potpuno se meša | |||
| log P | −0,13[5] | ||
| Napon pare | 48 mmHg (20 °C)[4] | ||
| Kiselost (pKa) | −1,4[6] | ||
| Konjugovana baza | Nitrat | ||
| Magnetna susceptibilnost | −1,99×10−5 cm³/mol | ||
| Indeks refrakcije (nD) | 1,397 (16,5 °C) | ||
| Dipolni moment | 2,17 ± 0.02 D | ||
| Termohemija | |||
Standardna molarna
entropija (S |
146 J·mol−1·K−1[7] | ||
Standardna entalpija
stvaranja (ΔfH |
−207 kJ·mol−1[7] | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | ICSC 0183 PCTL Safety Website | ||
| GHS piktogrami |    
| ||
| GHS signalne reči | Opasnost | ||
| H272, H300, H310, H330, H373, H411 | |||
| P210, P220, P260, P305+351+338, P310, P370+378 | |||
| NFPA 704 | |||
| Tačka paljenja | Nije zapaljiva | ||
| Smrtonosna doza ili koncentracija (LD, LC): | |||
LC50 (srednja koncetracija)
|
138 ppm (pacov, 30 min)[4] | ||
| Granice izloženosti zdravlja u SAD (NIOSH): | |||
PEL (dozvoljeno)
|
TWA 2 ppm (5 mg/m3)[4] | ||
REL (preporučeno)
|
TWA 2 ppm (5 mg/m3) ST 4 ppm (10 mg/m3)[4] | ||
IDLH (trenutna opasnost)
|
25 ppm[4] | ||
| Srodna jedinjenja | |||
Drugi anjoni
|
Azotasta kiselina | ||
Drugi katjoni
|
Natrijum nitrat Kalijum nitrat Amonijum nitrat | ||
Srodna jedinjenja
|
Azot-pentoksid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |||
| Reference infokutije | |||
Čisto jedinjenje je bezbojno, dok drugi uzorci teže da poprime žute nijanse usled dekompozicije u okside azota i vodu. Najveći deo prodajno dostupne azotne kiseline ima koncentraciju od 68% u vodi. Kad rastvor sadrži više od 86% HNO3, on se naziva dimućom azotnom kiselinom. U zavisnosti od količine prisutnog azot-dioksida, dimuća azotna kiselina se dalje karakteriše kao bela dimuća azotna kiselina pri koncentracijama iznad 95%, ili crvena dimuća azotna kiselina pri koncentracijama iznad 86%.
Azotna kiselina je primarni reagens koji se koristi za nitraciju – adiciju nitro grupe, tipično u organske molekule. Dok su neka od rezultirajućih nitro jedinjenja senzitivna na udar i toplotu, te se koriste kao eksplozivi, mali broj njih je dovoljno stabilan da bi se koristio u municiji i za demolaciju. Druga jedinjenja su još stabilnija i koriste se kao pigmenti u mastilima i bojama. Azotna kiselina se takođe često koristi kao jak oksidacioni agens.
Hemijske osobine
urediAzotna kiselina u vodenom rastvoru u potpunosti disosuje do NO3- anjona i slobodnog protona koji se vezuje sa molekulima vode iz rastvora gradeći hidronijum jon (H3O+).[8][9][10]
Jako je oksidaciono sredstvo. Može da izreaguje čak i sa površinskim slojem plemenitih metala, zbog čega se koristi u spremanju carske vode, koja može da rastvara zlato i platinu. Na sobnoj temperaturi to je bezbojna tečnost koja lako isparava, pogotovu pri većim koncentracijama, odavajući žuta do crvenih isparenja.
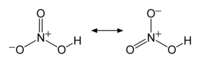
Azotna kiselina gradi veliki broj soli - nitrata - koji su veoma velika i važna grupa jedinjenja. Većina je polarna, te vrlo dobro rastvorna u polarnim rastvaračima, prvenstveno vodi i etanolu. Veze između azota i kiseonika (kako u kiselini tako i u nitratnoj grupi) su sve jednake dužine, sa sp2 hibridizovanim atomom azota, i uglom između veza od 120°, što odgovara planearnom obliku nitratne (nitro) grupe.
Dobijanje
urediAzotna kiselina se može dobiti mešanjem azot (IV)-oksida sa vodom pri čemu se dobija smeša azotne i azotaste kiseline. Prečišćavanje ove smeše se najčešće vrši destilacijom sa sumpornom kiselinom, koja je higroskopna supstanca, pri čemu se povećava udeo azotne kiseline u rastvoru. Azotna kiselina industrijske jačine varira između 50-68%. U laboratoriji se može dobiti i dejstvom koncentrovane sumporne kiseline (H2SO4) na kalijum nitrat (KNO3), i naknadnom destilacijom na temperaturi ključanja nitratne kiseline (83 °C), pri čemu se izdvaja tzv. crvena pušljiva azotna kiselina (u gasnoj fazi) koju je moguće prevesti u konvencionalnu (belu) azotnu kiselinu. Pritom, u destilacionoj posudi ostaje kristalizovan kalijum hidrogensulfat (KHSO4)
Na industrijskom nivou, dobija se Ostvaldovim procesom, nazvanim po Vilhelmu Ostvaldu, oksidacijom amonijaka.
Upotreba
urediU laboratoriji, azotna kiselina je veoma važan reagens, dok je njena upotreba u industriji još značajnija. Koristi se u procesima dobijanja eksploziva (kao nitroglicerin, trinitrotoluen), veštačkih đubriva (amonijum nitrat), prečišćavanja metala u metalurgiji kao i u nekim organskim sintezama.
Bela pušljiva azotna kiselina (koja je praktično anhidrirana kiselina, teoretske ili približne jačine) koristi se kao oksidant u raketama na tečno gorivo.
U kontaktu sa kožom izaziva teške hemijske opekotine karakteristične žute boje, koja je proizvod reakcije kiseline sa jednim od proteina u koži - keratinom.
Reakcije
urediKiselinsko-bazna svojstva
urediAzotna kiselina se normalno smatra jakom kiselinom na sobnoj temperaturi. Postoji izvesno neslaganje u pogledu vrednosti konstante disocijacije ove kiseline, mada se pKa vrednost obično navodi kao manja od −1. To znači da je azotna kiselina u razblaženim rastvorima potpuno disocirana izuzev u ekstremno kiselim rastvorima. pKa vrednost se povećava do 1 pri temperaturi od 250 °C.[11]
Azotna kiselina može da reaguje kao baza u odnosu na kiselinu kao što je sumporna kiselina:
- HNO3 + 2 H2SO4 ⇌ NO+
2 + H3O+ + 2 HSO−
4; Konstanta ravnoteže: K ≈ 22
Nitronijum jon, NO+
2, je aktivni reagens u reakcijama aromatične nitracije. Pošto azotna kiselina ima kiselinska i bazna svojstva, ona može da podlegne reakcijama autoprotolize, poput samojonizacije vode:
- 2 HNO3 ⇌ NO+
2 + NO−
3 + H2O
Reakcije sa metalima
urediAzotna kiselina reaguje sa većinom metala, ali detalji zavise od koncentracije kiseline i prirode metala. Razblažena azotna kiselina se ponaša kao tipična kiselina u svojim reakcijama sa većinom metala. Magnezijum, mangan, i cink oslobađaju H2:
- Mg + 2 HNO3 → Mg(NO3)2 + H2 (magnezijum nitrat)
- Mn + 2 HNO3 → Mn(NO3)2 + H2 (mangan nitrat)
Azotna kiselina može da oksiduje neaktivne metala kao što su bakar i srebro. Sa tim neaktivnim ili manje elekropozitivnim metalima produkti zavise od temperature i koncentracije kiseline. Na primer, bakar reaguje sa razblaženom azotnom kiselinom na sobnoj temperaturi sa 3:8 stehiometrijom:
- 3 Cu + 8 HNO3 → 3 Cu2+ + 2 NO + 4 H2O + 6 NO−
3
Proizvedeni azotni oksid može da reaguje sa atmosferskim kiseonikom i da formira azot-dioksid. Sa koncentrovanijom azotnom kiselinom, azot-dioksid se direktno formira u reakciji sa 1:4 stehiometrijom:
- Cu + 4 H+ + 2 NO−
3 → Cu2+ + 2 NO2 + 2 H2O
Nakon reakcije sa azotnom kiselinom, većina metala formira korespondirajuće nitrate. Pojedini metaloidi i metali daju okside; na primer, Sn, As, Sb, i Ti se oksiduju u SnO2, As2O5, Sb2O5, i TiO2 respektivno.[12]
Pojedini plemeniti metali, kao što je čisto zlato i metali platinske grupe ne reaguju sa azotnom kiselinom, mada čisto zlato reaguje sa carskom vodom, mešavinom koncentrovane azotne kiseline i hlorovodonične kiseline. Neki manje plemeniti metali (Ag, Cu, ...) prisutni u pojedinim legurama zlata relativno siromašnim zlatom, kao što je obojeno zlato, mogu lako da budu oksidovani i rastvoreni azotnom kiselinom, što dovodi do promene boje površine legure zlata. Azotna kiselina se koristi kao jeftino sredstvo u prodavnicama nakita za brzo određivanje legura sa niskim sadržajem zlata (< 14 karata) i za brzu procenu čistoće zlata.
Kao jak oksidujući agens, azotna kiselina burno reaguje sa mnogim nemetalnim jedinjenima, i reakcije mogu da budu eksplozivne. U zavisnosti od koncentracije kiseline, temperature i redukujućeg agensa, krajnji produkti su varijabilni. Reakcije se odvijaju sa svim metalima izuzev plemenitih metala i pojedinih legura. Kao generalno pravilo, reakcije oksidacije se prvenstveno odvijaju sa koncentrovanom kiselinom, pri čemu se uglavnom formira azotni oksid (NO2). Jaka oksidaciona svojstva azotnog oksida su u većini slučajeva termodinamičke prirode, mada ponekad njene oksidativne reakcije nisu kinetički povoljne. U prisustvu malih količina azotaste kiseline (HNO2) dolazi do znatnog povećanja brzine reakcije.[12]
Hrom (Cr), gvožđe (Fe), i aluminijum (Al) se brzo rastvaraju u razblaženoj azotnoj kiselini, dok koncentrovana kiselina formira sloj metalnog oksida koji štiti glavninu metala od dalje oksidacije. Formiranje tog zaštitnog sloja se naziva pasivizacijom. Tipični pasivizacioni koncentracioni opsezi su od 20% do 50% po zapremini (pogledajte ASTM A967-05). Metali koji bivaju pasivizirani koncentrovanom azotnom kiselinom su gvožđe, kobalt, hrom, nikal, i aluminijum.[12]
Reakcije sa nemetalima
urediKao moćna oksidujuća kiselina, azotna kiselina burno reaguje sa mnogim organskim materijalima i te reakcije mogu da budu eksplozivne. Hidroksilna grupa tipično uklanja vodonik sa organskog molekula formirajući vodu, a preostala nitro grupa zauzima vodonikovo mesto. Nitracija organskih jedinjenja sa azotnom kiselinom je primarni metod sinteze mnogih eksploziva, kao što su nitroglicerin i trinitrotoluen (TNT). Moguće je stvaranje mnoštva manje stabilnih nuzproizvoda, iz kog razloga ove reakcije moraju da budu pažljivo termički kontrolisane, i nusproizvodi uklonjeni da bi se izolovao željeni produkat.
Reakcija sa nemetalnim elementima, izuzev azota, kiseonika, plemenitih gasova, silicijuma, i halogena osim joda, obično dovodi do oksidacije sve do njihovih najviših oksidacionih stanja kao kiseline, sa formiranjem azot oksida pri primeni koncentrovane kiseline i azot monoksida pri primeni razblažene kiseline.
- Cgrafit + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
ili
- -{3 C-grafit + 4 HNO3 → 3 CO2 + 4 NO + 2 H2O
Koncentrovana azotna kiselina oksiduje I2, P4, i S8 u HIO3, H3PO4, i H2SO4.[12] Ona reaguje sa grafitom i amorfnim ugljenikom, a ne reaguje sa dijamantom; ona može da odvoji dijamant od grafita koji oksiduje.[13]
Ksantopreinski test
urediAzotna kiselina reaguje sa proteinima da formira žute nitrisane produkte. Ova reakcija je poznata kao ksantoproteinska reakcija. Ovaj test se izvodi dodavanjem koncentrovane azotne kiseline u testiranu supstancu, i zatim se smeša zagreva. Ako su prisutni proteini koji sadrže aminokiseline sa aromatičnim prstenovima, smeša postaje žuta. Nakon dodavanja baze kao što je amonijak, boja postaje narandžasta. Ove promene boja su uzrokovane nitracijom aromatičnih prstenova u proteinu.[14][15] Ksantoproteinska kiselina se formira kad kiselina dođe u kontakt sa epitelnim ćelijama. Respektivne lokalne promene boje kože su indikacija neadekvatnih mera bezbednosti pri rukovanju azotnom kiselinom.
Reference
uredi- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ a b v g d đ e NIOSH Džepni vodič hemijskih hazarda. „#0447”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ „nitric acid_msds”.
- ^ Bell, R. P. (1973), The Proton in Chemistry (2nd izd.), Ithaca, NY: Cornell University Press
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. str. A22. ISBN 978-0-618-94690-7.
- ^ David L. Nelson; Michael M. Cox (2005). Principles of Biochemistry (IV izd.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ur. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th izd.). Merck Publishing. ISBN 0911910131.
- ^ IUPAC SC-Database Arhivirano na sajtu Wayback Machine (19. jun 2017) A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ a b v g Housecroft, Catherine E. G. Sharpe; Alan (2008). „Chapter 15: The group 15 elements”. Inorganic Chemistry (3rd izd.). Pearson. ISBN 978-0-13-175553-6.
- ^ Ōsawa, Eiji (decembar 2007). „Recent progress and perspectives in single-digit nanodiamond”. Diamond and Related Materials. 16 (12): 2018—2022. doi:10.1016/j.diamond.2007.08.008.
- ^ Sherman, Henry Clapp (2007). Methods of organic analysis. Read Books. str. 315. ISBN 978-1-4086-2802-7.
- ^ Knowles, Frank (2007). A practical course in agricultural chemistry. Read Books. str. 76. ISBN 978-1-4067-4583-2.
Literatura
uredi- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. str. A22. ISBN 978-0-618-94690-7.
Spoljašnje veze
uredi- NIOSH Pocket Guide to Chemical Hazards
- National Pollutant Inventory – Nitric Acid Fact Sheet
- Calculators: surface tensions Arhivirano na sajtu Wayback Machine (22. februar 2020), and densities, molarities and molalities Arhivirano na sajtu Wayback Machine (22. februar 2020) of aqueous nitric acid