Азот-пентоксид
Азот-пентоксид је оксид азота хемијске формуле N2O5, где је оксидациони број азота +5.

| |
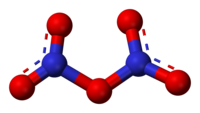 модел молекула
| |
| Називи | |
|---|---|
| IUPAC назив
Динитроген-пентоксид
| |
| Други називи
Азот (V)-оксид
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.030.227 |
| MeSH | Dinitrogen+pentoxide |
| |
| |
| Својства | |
| N2O5 | |
| Моларна маса | 108,01 g/mol |
| Агрегатно стање | бела чврста супстанца |
| Густина | 2,05 g/cm3, основно |
| Тачка кључања | 32.4 ºC сублимира |
| реагује дајући азотну киселину | |
| Структура | |
| Облик молекула (орбитале и хибридизација) | планарни, C2v (приближно D2h) N–O–N ≈ 180º |
| Термохемија | |
Стандардна моларна
ентропија (S |
178.2 J K−1 mol−1 (s) 355.6 J K−1 mol−1 (g) |
Стандардна енталпија
стварања (ΔfH |
−43.1 kJ/mol (s) +11.3 kJ/mol (g) |
| Опасности | |
| Главне опасности | јак оксидант, ствара јаку киселину у контакту са водом |
| NFPA 704 | |
| Тачка паљења | не гори |
| Сродна једињења | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Добијање
уредиМоже се добити на више начина[3]:
1. дејством азотне киселине на оксид фосфора:
2. дејством хлора на сув сребро-нитрат:
3. дејством озона на азот-пероксид:
Особине
уредиОво је бела кристална супстанца која под обичним притиском сублимује, не топећи се, а изнад тачке кључања се распада. Уколико се брзо загрева, доћи ће до експлозије[3][4][5]:
Азот-пентоксид је анхидрид азотне киселине[3]:
| Особина | Вредност |
|---|---|
| Партициони коефицијент[6] (ALogP) | 4,2 |
| Растворљивост[7] (logS, log(mol/L)) | -2,9 |
| Поларна површина[8] (PSA, Å2) | 100,9 |
Извори
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в Паркес, Г. Д. & Фил, Д. 1973. Мелорова модерна неорганска хемија. Научна књига. Београд.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
Литература
уреди- Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
