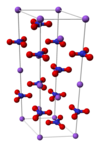
Natrijum nitrat
Natrijum nitrat NaNO3 je važan nitrat koji se javlja u prirodi.[4] Ova so alkalnog metalnog nitrata je isto tako poznata kao čileanska šalitra (čiji masivni depoziti su istorijski iskopavani u Čileu)[5][6] da bi se razlikovala od obične šalitre, kalijum nitrata. Njegova mineralna forma je isto tako poznata kao nitratin, nitratit ili sodni niter. Manjih nalazišta ima u Egiptu, Maloj Aziji, Kolumbiji i Kaliforniji, ali od tehničkog značaja su samo nalazišta u Čileu.

| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Natrijum nitrat
| |||
| Drugi nazivi
Peruvanska šalitra
Sodni niter kubic niter | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.028.686 | ||
| EC broj | 231-554-3 | ||
| E-brojevi | E251 (konzervansi) | ||
| RTECS | WC5600000 | ||
| UNII | |||
| UN broj | 1498 | ||
| |||
| Svojstva | |||
| NaNO3 | |||
| Molarna masa | 84,9947 g/mol | ||
| Agregatno stanje | Beli prah ili bezbojni kristali | ||
| Miris | sladak | ||
| Gustina | 2,257 g/cm3, čvrst | ||
| Tačka topljenja | 308 °C (586 °F; 581 K) | ||
| Tačka ključanja | 380 °C (716 °F; 653 K) razlaže se | ||
| 73 g/100 mL (0 °C) 92.1 g/100 ml (25 °C) 180 g/100mL (100 °C) | |||
| Rastvorljivost | veoma rastvoran u amonijaku; rastvoran u alkoholu | ||
| −25,6·10−6 cm3/mol | |||
| Indeks refrakcije (nD) | 1,587 (trigonalni) 1,336 (romobohedralni) | ||
| Viskoznost | 2,85 cP (317 °C) | ||
| Struktura | |||
| Kristalna rešetka/struktura | trigonalni i rombohedralni | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 93,05 J/(mol K) | ||
| Standardna molarna entropija S |
116 J/(mol K)[3] | ||
Std entalpija
formiranja (ΔfH⦵298) |
−467 kJ/mol[3] | ||
Gibsova slobodna energija (ΔfG˚)
|
−365,9 kJ/mol | ||
| Opasnosti | |||
| Opasnost u toku rada | Štetan (Xn) Oksidant (O) | ||
| Bezbednost prilikom rukovanja | ICSC 0185 | ||
| GHS grafikoni |  
| ||
| NFPA 704 | |||
| Tačka paljenja | Nezapaljiv | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
3236 mg/kg | ||
| Srodna jedinjenja | |||
Drugi anjoni
|
Natrijum nitrit | ||
Drugi katjoni
|
Litijum nitrat Kalijum nitrat Rubidijum nitrat Cezijum nitrat | ||
Srodna jedinjenja
|
Natrijum sulfat Natrijum hlorid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||

Natrijum nitrat je bela čvrsta materija koja je veoma rastvorna u vodi. On je lako dostupan izvor nitratnog anjona (NO3−), koji je koristan u nekoliko reakcija koje se izvode na industrijskim razmerama za proizvodnju đubriva, pirotehnike i dimnih bombi, staklenih i keramičkih emajla, konzervanasa hrane (posebno mesa), i kao čvrsto raketno gorivo. Za te svrhe je ekstenzivno iskopavan.
Istorija
уредиPrva pošiljka peruanske slatine u Evropi stigla je u Englesku 1820. ili 1825. godine, neposredno nakon sticanja nezavisnosti te zemlje od Španije, ali nije pronašla kupce i bačena je u more kako bi izbegla carinska naknada.[7][8] Međutim, vremenom je rudarstvo južnoameričke slatine postalo profitabilan posao (godine 1859. sama Engleska je potrošila 47.000 tona[8]). Čile se borio u Pacifičkom ratu (1879-1884) protiv savezničkih snaga Perua i Bolivije i preuzeo je njihove najbogatije naslage šalitre. Godine 1919, Ralf Valter Grejston Vikof je odredio kristalnu strukturu natrijum nitrata koristeći rendgensku kristalografiju.
Dobijanje
уредиNajveće akumulacije prirodnog natrijum nitrata nalaze se u Čileu i Peruu, gde su soli nitrata vezane unutar mineralnih naslaga zvanih kališna ruda.[9] Nitrati se akumuliraju na kopnu putem taloženja morske magle i oksidacije/desikacije morskog spreja, nakon čega sledi gravitaciono taloženje NaNO3, KNO3, NaCl, Na2SO4, i I u vrućoj suvoj pustinjskoj atmosferi.[10] Ekstremni ciklusi El Ninjo/La Ninja bezvodnosti/ bujičnih kiša favorizuju akumulaciju nitrata kroz aridnost i vodeno rastvaranje/remobilizaciju/transport na padine i u slivove; pokretanjem kapilarnog rastvora formiraju se slojevi nitrata; čisti nitrat formira retke vene. Tokom više od jednog veka, svetsko snabdevanje ovim jedinjenjem je omogućavano skoro isključivo iskopavanjem iz pustinje Atakama u severnom Čileu, dok su, na početku 20. veka, nemački hemičari Fric Haber i Karl Boš razvili proces za proizvodnju amonijaka iz atmosfere u industrijskim razmerama (vidi Haberov proces). Sa početkom Prvog svetskog rata, Nemačka je počela da pretvara amonijak iz ovog procesa u sintetičku čileansku šalitru, koja je bila praktična kao prirodno jedinjenje u proizvodnji baruta i druge municije. Do 1940-ih, ovaj proces konverzije rezultirao je dramatičnim padom potražnje za natrijum nitratom nabavljenim iz prirodnih izvora.
Čile i dalje ima najveće rezerve kaliče, sa aktivnim rudnicima na mestima kao što su Pedro de Valdivija, Marija Elena i Pampa Blanka, i tamo se ona nekada nazivala belim zlatom.[5][6] Natrijum nitrat, kalijum nitrat, natrijum sulfat i jod se dobijaju obradom kaliče. Nekadašnje čileanske šalitrene rudarske zajednice Humberstona i Santa Laura proglašene su za Uneskovim lokacijama svetske baštine 2005. godine.
Sirova čilska šalitra većinom nije čista, nego se javlja sa pijeskom i glinom, te raznim drugim solima (najčešće natrijum hloridom). Osim toga sadrži primese natrijum-, magnezijum- i kalcijum- sulfata i malim količinama kalcijum jodata, te je siva ili smeđa kamena masa. Iz ovog materijala dobija se natrijum nitrat izluživanjem vrućom vodom. Pritom se nastali rastvor natrijum nitrata filtrira da se odvoji glineni mulj i zaostali nerastvoreni natrijum hlorid, a zatim se hladi pri čemu kristalizira. Dobiveni natrijum nitrat je 98% čist. Matični lugovi sadrže natrijum jodat i služe za dobijanje joda.[11]
U Nemačkoj se natrijum nitrat dobija pretežno iz sode sa azotnom kiselinom:
- Na2CO3 + 2 HNO3 → 2 NaNO3 + H2O + CO2
- HNO3 + NaHCO3 → NaNO3 + H2O + CO2
i to tako da se nitrozni otpadni plinovi od oksidacije amonijaka apsorbiraju u rastvoru sode. Pritom nastali rastvor nitrita i nitrata (Na2CO3 + 2 NO2 → NaNO2 + NaNO3 + CO2) se zakiseli azotnom kiselinom i oksidira se u vazduhu u nitrat, koji se sodom neutrališe i upari u vakuumskim isparivačima.
Natrijum nitrat se takođe industrijski sintetiše neutralizacijom azotne kiseline natrijum hidroksidom (međutim, ova reakcija je veoma egzotermna):
- HNO3 + NaOH → NaNO3 + H2O
ili mešanjem stehiometrijskih količina amonijum nitrata i natrijum hidroksida, natrijum bikarbonata ili natrijum karbonata:
- NH4NO3 + NaOH → NaNO3 + NH4OH
- NH4NO3 + NaHCO3 → NaNO3 + NH4HCO3
- 2NH4NO3 + Na2CO3 → 2NaNO3 + (NH4)2CO3
Osobine
уредиNatrijum nitrat kristalizira iz vodenog rastvora u obliku bezbojnih, kockastih romboedara (kubična šalitra), koji imaju tačku topljenja na 307 °C, a kod 380 °C počinju da se degradiraju. U vodi se lako rastvara i rastvorljivost mu jako raste sa porastom temperature.[12]
Upotreba
уредиVeći deo čilske šalitre ranije se koristio za proizvodnju đubriva, ostali deo se upotrebljavao za dobijanje azotne kiseline i kalijumove šalitre. Danas natrijum-nitrat ima značaj samo kao veštačko đubrivo.
Natrijum nitrat se može kombinovati sa sumpornom kiselinom i azotna kiselina se može izdestilisati. Pri nižem pritisku potrebna je niža temperatura, što dovodi do manjeg raspadanja. Teoretski 2 mola azotne kiseline na 1 mol sumporne kiseline dovodi do vrlo visoke krajnje temperature, velikog raspadanja i čvrstog neutralnog sulfata koji je teško ukloniti. Kada je ova reakcija bila industrijski važna, uobičajena je praksa bila da se radi sa sumpornom kiselinom u višku, i da se okonča sa pretežno bisulfatnim produktom koji se rastopljen izlivao iz retorte. Prerađivači zlata, koji se time bave kao hobi, koriste natrijum nitrat da bi napravili hibridnu carsku vodu koja rastvara zlato i druge metale.
Natrijum nitrat je takođe prehrambeni aditiv koji se koristi kao konzervans i sredstvo za fiksiranje boje u suvom mesu i živini. On je naveden pod brojem INS 251 ili kao E broj E251. Odobren je za upotrebu u EU,[13] SAD[14] i Australiji i Novom Zelandu.[15] Natrijum nitrat ne treba poistovećivati sa natrijum nitritom, koji je takođe uobičajen prehrambeni aditiv i konzervans koji se koristi, na primer, u mesnim delikatesama.
Manje uobičajene primene su kao oksidans u vatrometu, pri čemu zamenjuje kalijum nitrat, koji se obično nalazi u crnom prahu, i kao komponenta u instant hladnim pakovanjima.[16]
Zdravstveni problemi
уредиStudije su pokazale vezu između povećanih nivoa nitrata i povećane smrtnosti od određenih bolesti uključujući Alzheimerovu bolest, dijabetes, rak želuca i Parkinsonovu bolest. Mogući uzroci su štetan uticaj nitrozamina na DNK, međutim, malo je urađeno na kontroli drugih mogućih uzroka u epidemiološkim rezultatima.[17] Nitrosamini, formirani u suvom mesu koje sadrže natrijum nitrat i nitrit, su bili povezani sa rakom želuca i rakom jednjaka.[18] Natrijum nitrat i nitrit su povezani sa povećanim rizikom od raka debelog creva.[19]
Jedan od razloga što obrađeno meso povećava rizik od raka debelog creva je njegov sadržaj nitrata. Mala količina nitrata koji se dodaje mesu kao konzervans razlaže se u nitrit, pored bilo kog nitrita koji se takođe može dodati. Nitrit zatim reaguje sa hranom bogatom proteinima (kao što je meso) čime se formiraju kancerogena nitrozo jedinjenja. Ova jedinjenja se mogu formirati pri preradi mesa ili u telu dok se meso vari.[20]
Reference
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. стр. A23. ISBN 978-0-618-94690-7.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ а б „The Nitrate Towns of Chile”. Atlas Obscura (на језику: енглески). Приступљено 27. 5. 2019.
- ^ а б Mutic, Anja (26. 10. 2012). „The ghost towns of northern Chile”. Washington Post (на језику: енглески). Приступљено 27. 5. 2019.
- ^ S. H. Baekeland "Några sidor af den kemiska industrien" (1914) Svensk Kemisk Tidskrift, p. 140.
- ^ а б Friedrich Georg Wieck, Uppfinningarnas bok (1873, Swedish translation of Buch der Erfindungen), vol. 4, p. 473.
- ^ Stephen R. Bown, A Most Damnable Invention: Dynamite, Nitrates, and the Making of the Modern World, Macmillan. 2005. ISBN 0-312-32913-X. стр. 157..
- ^ Arias, Jaime (24. 7. 2003). On the Origin of Saltpeter, Northern Chile Coast. International Union for Quaternary Research. Архивирано из оригинала 04. 03. 2016. г. Приступљено 19. 8. 2018.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ UK Food Standards Agency: „Current EU approved additives and their E Numbers”. Приступљено 27. 10. 2011.
- ^ US Food and Drug Administration: „Listing of Food Additives Status Part II”. Приступљено 27. 10. 2011.
- ^ Australia New Zealand Food Standards Code„Standard 1.2.4 - Labelling of ingredients”. Приступљено 27. 10. 2011.
- ^ Albert A. Robbins "Chemical freezing package" U.S. Patent 2.898.744, Issue date: August 1959.
- ^ De La Monte, SM; Neusner, A; Chu, J; Lawton, M (2009). „Epidemilogical trends strongly suggest exposures as etiologic agents in the pathogenesis of sporadic Alzheimer's disease, diabetes mellitus, and non-alcoholic steatohepatitis”. Journal of Alzheimer's Disease. 17 (3): 519—29. PMC 4551511 . PMID 19363256. doi:10.3233/JAD-2009-1070.
- ^ Jakszyn, Paula; Gonzalez, Carlos-Alberto (21. 7. 2006). „Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence”. World Journal of Gastroenterology. 12 (27): 4296—4303. PMC 4087738 . PMID 16865769. doi:10.3748/wjg.v12.i27.4296. Архивирано из оригинала 14. 10. 2018. г. Приступљено 18. 06. 2019.
- ^ Cross, AJ; Ferrucci, LM; Risch, A; Graubard, BI; Ward, MH; Park, Y; Hollenbeck, AR; Schatzkin, A; Sinha, R (2010). „A large prospective study of meat consumption and colorectal cancer risk: An investigation of potential mechanisms underlying this association”. Cancer Research. 70 (6): 2406—14. PMC 2840051 . PMID 20215514. doi:10.1158/0008-5472.CAN-09-3929.
- ^ „The Associations between Food, Nutrition and Physical Activity and the Risk of Colorectal Cancer” (PDF). World Cancer Research Fund. 2010. Архивирано из оригинала (PDF) 26. 07. 2019. г. Приступљено 18. 06. 2019.
Literatura
уреди- Barnum, Dennis (2003). „Some History of Nitrates”. Journal of Chemical Education. 80 (12): 1393—. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
Spoljašnje veze
уреди- ATSDR – Case Studies in Environmental Medicine – Nitrate/Nitrite Toxicity Архивирано на сајту Wayback Machine (4. март 2010) U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- Calculators: surface tensions Архивирано на сајту Wayback Machine (22. фебруар 2020), and densities, molarities and molalities Архивирано на сајту Wayback Machine (22. фебруар 2020) of aqueous sodium nitrate