Tetranitrometan
Tetranitrometan ili TNM je organsko jedinjenje to jest oksidator sa hemijskom formulom C(NO
2)
4. Njegova hemijska struktura se sastoji od četiri nitro grupe vezane za jedan atom ugljenika i ima molekulsku masu od 196,033 Da. Prvi put je sintetisan 1857. godine reakcijom natrijum-cijanoacetamida sa azotnom kiselinom. [7]
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Tetranitrometan
| |||
| Drugi nazivi
TNM
Tetan | |||
| Identifikacija | |||
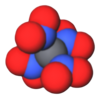
3D model (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.007.359 | ||
| EC broj | 208-094-7 | ||
| KEGG[2] | |||
| RTECS | PB4025000 | ||
| UNII | |||
| UN broj | 1510 | ||
| |||
| Svojstva | |||
| C(NO 2) 4 | |||
| Molarna masa | 196,04 g/mol | ||
| Agregatno stanje | Bezbojna do bledožuta tečnost ili čvrsta supstanca | ||
| Miris | Pungent | ||
| Gustina | 1,623 g/cm3 | ||
| Tačka topljenja | 138 °C (280 °F; 411 K) | ||
| Tačka ključanja | 126 °C (259 °F; 399 K) | ||
| nerastvorljiv | |||
| Napon pare | 8 mmHg (20°C)[5] | ||
| -43.02·10−6 cm3/mol | |||
| Opasnosti | |||
| Opasnost u toku rada | Oksidant, može formirati eksplozivne smeše | ||
| Bezbednost prilikom rukovanja | ICSC 1468 | ||
| GHS grafikoni |    
| ||
| GHS signalna reč | Opasnost | ||
| H271, H301, H315, H319, H330, H335, H351 | |||
| P201, P202, P210, P220, P221, P260, P261, P264, P270, P271, P280, P281, P283, P284 | |||
| NFPA 704 | |||
| Letalna doza ili koncentracija (LD, LC): | |||
LC50 (LC50)
|
18 ppm (rat, 4 hr) 100 ppm (cat, 20 min) 54 ppm (mouse, 4 hr) [6] | ||
| SAD zdravstvene granice izlaganja (NIOSH): | |||
PEL (dozvoljivo)
|
TWA 1 ppm (8 mg/m3)[5] | ||
REL (preporučeno)
|
TWA 1 ppm (8 mg/m3)[5] | ||
IDLH (neposredna opasnost)
|
4 ppm [5] | ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
Heksanitroetan Oktanitropentan Trinitrometan | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Osobine
уреди| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 8 |
| Broj donora vodonika | 0 |
| Broj rotacionih veza | 4 |
| Particioni koeficijent[8] (ALogP) | 2,4 |
| Rastvorljivost[9] (logS, log(mol/L)) | -8,3 |
| Polarna površina[10] (PSA, Å2) | 183,3 |
Upotrebe
уредиIspitivan je za upotrebu kao oksidator u bipropelantnim raketama. Visoko prečišćen tetranitrometan ne može se naterati da eksplodira, ali njegova osetljivost se drastično povećava u prisustvu oksidabilnih zagađivača, poput aditiva protiv smrzavanja. [11] Čista supstanca takođe ima previsoku tačku mržnjenja da bi ostala pouzdano u tečnom stanju, iako eutektička smeša sa dinitrogen tetraoksidom mrzne na znatno nižih −30 °C (−22 °F; 243 K) i manje je eksplozivna od skoro čistog tetranitrometana. [12] Ipak, oksidator je i dalje previše osetljiv za bilo kakvu efikasnu upotrebu. [11][12]
U laboratoriji se koristi kao reagens za detekciju dvostrukih veza u organskim jedinjenjima i kao nitrirajući reagens. Takođe je našao primenu kao aditiv za dizel gorivo za povećanje cetanskog broja. [13]
Priprema
уредиTNM je bledo žuta tečnost koja se može pripremiti u laboratoriji nitracijom acetanhidrida sa bezvodnom azotnom kiselinom (Katavay-ova metoda). [14] Ova metoda je pokušana na industrijskoj skali 1950-ih godina od strane kompanije Nitroform Products u Njujorku, SAD, ali je cela fabrika uništena eksplozijom 1953. godine. [15]
Prva industrijska proizvodnja započeta je u Nemačkoj tokom Drugog svetskog rata u nastojanju da se poboljša cetanski broj dizel goriva. Ovaj proces je unapredio originalnu metodu koja je počinjala sa sirćetnom kiselinom i azotnom kiselinom. [16] Bez obzira na prinos ili troškove, približno 10 tona TNM-a je proizvedeno u nekoliko nedelja. Međutim, ovaj proizvodni proces nije ponovo korišćen industrijski nakon završetka rata zbog visokih povezanih troškova. [17]
Za komercijalnu upotrebu korišćena je jeftinija metoda koja počinje od acetilena. [18] Prvo, azotna kiselina koja sadrži nitrat žive redukuje se acetilenom, što rezultira trinitrometanom (nitroformom) i mešavinom ugljen-dioksida i azotnog oksida kao otpadnim gasom. Azotni oksidi su vredni i obično se povrate kao azotna kiselina u apsorpcionom tornju. Dobijeni nitroform se pretvara u TNM dodavanjem azotne i sumporne kiseline na višim temperaturama. Ovom metodom može se postići prinos od 90% (na bazi azotne kiseline) pre prečišćavanja. [19]
Struktura
уредиTNM je izuzetan primer molekularne fleksibilnosti. Doveo je strukturne metode do granica njihove primenljivosti, što pokazuje činjenica da se struktura TNM-a pokušavala odrediti tokom više od 70 godina u različitim fazama. [14]
Rana istraživanja difrakcijom elektrona u gasnoj fazi nisu mogla u potpunosti opisati posmatrani difrakcioni obrazac, i tek je primena četvorodimenzionalnog modela koji se odnosi na korelisano kretanje četiri NO
2 grupe oko C–N veza uspela da u potpunosti opiše eksperimentalna zapažanja. Problem nastaje zbog toga što dvostruka lokalna simetrija C−NO
2 jedinica naspram trostruke simetrije C(NO
2)
3 jedinice, kao i bliska blizina NO
2 grupa koja ometa njihovu slobodnu rotaciju, predstavlja izvor vrlo složenog međusobno ometanog kretanja NO
2 grupa.
Kristalna struktura je takođe pokušavana odrediti nekoliko puta. Prvo zadovoljavajuće rešenje problema zahtevalo je model koji opisuje visokoneuređenu visokotemperaturnu kristalnu fazu (>174,4 K), kao što je prikazano na Slici 1. Smanjenje simetrije i analiza blizanačkih kristala konačno su doveli do rešene neuređenosti strukture prikazane na Slici 2.
Struktura uređene niskotemperaturne faze sadrži tri nezavisne molekule u asimetričnoj jedinici. Strukturni parametri gasne i čvrste faze navedeni su u sledećoj tabeli za poređenje.
| Parameter | GED | XRD (opseg) |
| rC–N | 1.509(5) | 1.502(4) – 1.554(5) |
| rN–O(eclip) | 1.201(3) | 1.198(4) – 1.215(5) |
| rN–O(stag) | 1.199(3) | 1.178(5) – 1.222(4) |
| ∡NCN_1 | 105.1(16) | 108.2(3) – 110.9(3) |
| ∡NCN_2 | 111.7(8) | 107.3(3) – 111.4(2) |
| ∡NCN_3 | 106.6(2) – 107.1(3) | |
| ∡ONO | 129.2(17) | 128.0(4) – 132.3(4) |
Fizička svojstva
уредиTetranitrometan je bezbojna uljasta lako isparljiva tečnost sa oštrim mirisom. U različitim priručnicima fizičko-hemijski parametri tetranitrometana se razlikuju; u ovom odeljku dati su podaci prihvaćeni od strane Međunarodnog biroa za fizičko-hemijske standarde i navedeni u pregledu hemije tetranitrometana iz 1976. godine. [20] Gustina na 20 °C: 1,63944 g/cm³. Tačka topljenja: 13,9 °C (57,0 °F; 287,0 K) , tačka ključanja pri normalnom pritisku: 127 °C (261 °F; 400 K).
Ne rastvara se u vodi, takođe se ne rastvara u sumpornoj kiselini i višeatomskim alkoholima. Rastvorljiv je u velikom broju organskih rastvarača i u koncentrisanoj azotnoj kiselini. Pri destilaciji se delimično razlaže, destiluje se sa vodenom parom ili pri smanjenom pritisku.
Hemijska svojstva
уредиS obzirom na prisustvo četiri nitro grupe u jednoj molekuli, tetranitrometan je snažan oksidator. Čisti tetranitrometan je slabo eksplozivna supstanca, ali sa organskim materijama formira eksplozivne smeše čija je snaga veća nego kod nitroglicerina.
Tetranitrometan u vodi ili alkoholnim rastvorima baza podleže hidrolizi uz formiranje trinitrometana ili njegovih soli:
Vodeni rastvori baza potpuno hidrolizuju tetranitrometan:
Tetranitrometan u prisustvu piridina u alkalnoj sredini nitrira organske spojeve. Pod dejstvom tetranitrometana korodiraju bakar i gvožđe, dok su aluminijum, nerđajući legure i staklo otporni.
Međutim, gvožđe je otporno na tetranitrometan ako se poslednjem doda sumporna kiselina u količini od 0,2% po masi. Ova okolnost omogućava skladištenje i transport tetranitrometana u gvozdenim posudama.
Priprema
уредиPrvi put je sintetisan od strane ruskog hemičara L. N. Šiškova 1857. godine nitracijom trinitrometana. [21] Tetranitrometan se dobija različitim metodama, [22] [23] među kojima su najpoznatije reakcije destruktivne nitracije acetilena, ketena ili acetanhidrida koncentrisanom azotnom kiselinom.
Destruktivna nitracija acetanhidrida
уредиReakcija destruktivne nitracije acetanhidrida odvija se prema jednačini:
Reagenti se mešaju u stehiometrijskom odnosu i održavaju se 5–7 dana na temperaturi od 25—28 °C (77—82 °F; 298—301 K). Prinos proizvoda iznosi 70–75%. Nastali tetranitrometan u obliku teške uljaste tečnosti odvaja se dekantacijom, destiluje sa vodenom parom i suši nad kalcijum-hloridom. Ova metoda je pogodna u laboratorijskim uslovima. Njena mana je dugotrajnost procesa nitracije. [24] Metoda je takođe primenjivana u industrijskim razmerama u SAD od strane kompanije Nitroform Products, međutim, 1953. godine fabrika za proizvodnju tetranitrometana je potpuno uništena eksplozijom, verovatni uzrok koje je bio porast temperature u reakcijskoj smeši usled kvara mešalice ili senzibilizacija smeše primesama katalizatora. [25]
Destruktivna nitracija acetilena
уредиReakcija destruktivne nitracije acetilena koncentrisanom azotnom kiselinom odvija se prema sledećoj globalnoj jednačini:
Pri tome prinos tetranitrometana iznosi približno 60%. Ova metoda je primenjivana tokom Drugog svetskog rata, pri čemu se sam proces nitracije odvijao u dve faze. Najpre se acetilen nitrirao do trinitrometana, koji se nije izdvajao iz reakcione smeše. Zatim se u drugoj fazi, sprovedenoj uz dodatak koncentrisane sumporne kiseline, trinitrometan se pretvarao u tetranitrometan, koji se odvajao od kiseline separacijom. Reakcija se izvodi na temperaturi od 40—50 °C (104—122 °F; 313—323 K) (ali ne višoj od 60 °C (140 °F; 333 K)) u prisustvu katalizatora (nitrat žive(II)). [25]
Bezbednost
уредиSposobnost TNM-a da detonira u velikoj meri je pod uticajem prisustva nečistoća, čak i u malim količinama. TNM formira izuzetno snažne eksplozivne smeše kada se goriva dodaju u stehiometrijskim proporcijama. Mnoge od ovih smeša pokazuju osetljivost na udar čak i veću od one kod nitroglicerina. [26]
Tetranitrometan se može koristiti kao komponenta visoko eksplozivnih tečnih eksploziva kao oksidaciono sredstvo. Formira visoko eksplozivne smeše sa svim zapaljivim supstancama. Prilikom eksperimentisanja sa ovom supstancom, papirni filteri ne bi trebalo da se koriste za filtraciju. Čak i male nečistoće čine tetranitrometan eksplozivom koji eksplodira na udar ili trenje. Dobro je poznat tragičan eksperiment na predavanju na Univerzitetu u Minsteru 1920. godine, gde je mala čelična cev koja je sadržala tetranitrometan, toluen i upijajući pamuk detonirala neposredno pre nego što je izgorela na takav način da je više od 30 studenata bilo povređeno, neki ozbiljno; [27] međutim, na osnovu zapisa rektorata, dokumentovano je čak 10 smrtnih slučajeva i više od desetak povreda. [28] Nakon toga je Nemački hemijsko-tehnički Rajhsanstalt odredio brzinu detonacije od 9.300 metara u sekundi. Alfred Stettbacher je zatim komparativno dokazao da je ova smeša bila daleko eksplozivnija od heksogena, pentrita, nitroglicerina ili panklastita i da je tako predstavljala najrazorniji eksploziv od svih.
TNM reaguje sa vlagom na povišenom pH da bi proizveo trinitrometan (nitroform), koji lako reaguje sa metalima da formira veoma nestabilne i eksplozivne soli. [29]
Tetranitrometan je veoma toksičan. Apsorpcija samo 2,5 mg/kg može izazvati methemoglobinemiju, plućni edem i oštećenje jetre, bubrega i centralnog nervnog sistema. Smatra se da je verovatno kancerogen za ljude. [30]
Toksičnost
уредиTetranitrometan je visokotoksična supstanca. U skladu sa GOST 12.1.005-76, tetranitrometan po stepenu uticaja na ljudski organizam pripada supstancama drugog stepena opasnosti. Prag koncentracije u vazduhu je 0,003 mg/l, maksimalno dozvoljena koncentracija je 0,001 mg/l [31] (u atmosferi); u vazduhu radnog prostora iznosi 0,3 mg/m³. Pri udisanju izaziva iritaciju respiratornog trakta. Pri dugotrajnom izlaganju izaziva methemoglobinemiju, plućni edem, oštećuje jetru, bubrege i centralni nervni sistem. Opasan je pri kontaktu sa sluzokožom i kožom, pri potkožnoj injekciji može izazvati nekrozu tkiva.
Istraživanja su pokazala da pare tetranitrometana mogu izazvati stvaranje malignih tumora u plućima (alveolarni i bronhijalni adenomi i karcinomi) kod pacova i miševa. Takođe je zabeležena pojava retkog oblika raka — pločastoćelijskog karcinoma. Zbog toga, uprkos nedostatku direktnih eksperimentalnih potvrda, tetranitrometan se sa značajnim stepenom verovatnoće smatra kancerogenom supstancom i za ljude. [32]
Vidi još
уредиReference
уреди- ^ Merck Index, 11th Edition, 9164.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г NIOSH Џепни водич хемијских хазарда. „#0605”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ „Tetranitromethane”. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ L. N. Shishkov (1857). „Sur la constitution de l'acetic fulminique et un nouvelle serie de corps derives de l'acide acetique”. Annales de chimie et de physique. 49 (11): 310.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ а б J. G. Tschinkel (1956). „Tetranitromethane as Oxidizer in Rocket Propellants”. Industrial and Engineering Chemistry. 48 (4): 732—735. doi:10.1021/ie50556a022.
- ^ а б Clark, John Drury (23. 5. 2018). Ignition!: An Informal History of Liquid Rocket Propellants. Rutgers University Press. стр. 17—18. ISBN 978-0-8135-9918-2.
- ^ K. V. Altukhov, V. V. Perekalin (1976). „The Chemistry of Tetranitromethane”. Russian Chemical Reviews. 45 (11): 1052—1066. Bibcode:1976RuCRv..45.1052A. S2CID 250859816. doi:10.1070/RC1976v045n11ABEH002759.
- ^ Liang, P. (1941). „Tetranitrometan” (PDF). Organic Syntheses. 21: 105.
- ^ Mahoney vs Nitroform Co., 114 A.2d 863 (NJ Appellate Div 1955).
- ^ F. D. Chattaway (1910). „A simple method of preparing tetranitromethane”. Journal of the Chemical Society. 97: 2099—2102. doi:10.1039/CT9109702099.
- ^ K. F. Hager (1949). „Tetranitromethane”. Industrial and Engineering Chemistry. 41 (10): 2168—2172. doi:10.1021/ie50478a028.
- ^ K. J. P. Orton, P. V. McKie (1920). „The action of nitric acid on unsaturated hydrocarbons. The action of nitric acid on acetylene”. Journal of the Chemical Society. 117: 283—297. doi:10.1039/CT9201700283.
- ^ Urbanski, Tadeusz (1964). Chemistry and Technology of Explosives. I. Pergamon Press. стр. 589—594. LCCN 83002261.
- ^ Алтухов, Перекалин, Химия тетранитрометана 1976, стр. 2052-2053.
- ^ Алтухов, Перекалин, Химия тетранитрометана 1976, стр. 2051.
- ^ Edited by Academician B. A. Kazansky, ур. (1952). Synthesis of Organic Compounds. Collection 3. Moscow: Foreign Literature Publishing House. стр. 411—413.
- ^ Poe Liang (1941). „Tetranitromethane” (PDF). Organic Syntheses. 21: 105. doi:10.15227/orgsyn.021.0105. Архивирано из оригинала (PDF) 4. 12. 2014. г.
- ^ Орлова, Химия и технология бризантных и взрывчатых веществ 1973, стр. 407.
- ^ а б Urbansky 1964, стр. 594.
- ^ Urbanski, Tadeusz (1964). Chemistry and Technology of Explosives. I. Pergamon Press. стр. 593. LCCN 83002261.
- ^ Royal Society of Chemistry: Explosion Accident at the Chemical Institute, University of Munster i.W., and Its Cause. In: J. Chem. Soc., Abstr., 1920, 118, ii457-ii483. doi:10.1039/CA9201805457
- ^ Universitätsarchiv Münster, NU E I 9 spec., Explosionsunglück im Chemischen Institut am 27. Mai 1920, Rüst, A. Ebert, K. Egli: Unfälle beim chemischen Arbeiten. Rascher, 1948, S. 23.
- ^ Gakh, A. A.; Bryan, J. C.; Burnett, M. N.; Bonnesen, P. V. (2000). „Synthesis and structural analysis of some trinitromethanide salts”. Journal of Molecular Structure. 520 (1–3): 221—228. Bibcode:2000JMoSt.520..221G. doi:10.1016/S0022-2860(99)00333-6.
- ^ National Toxicology Program (2011). „Tetranitromethane” (PDF). Report On Carcinogens (12th изд.). National Toxicology Program. Архивирано (PDF) из оригинала 2013-01-31. г. Приступљено 2012-08-14.
- ^ Алтухов, Перекалин, Химия тетранитрометана 1976, стр. 2054.
- ^ PMID 21863104 (PMID 21863104)
Референца ће бити завршена аутоматски за неколико минута. Прескочи ред или прошири ручно
Literatura
уреди- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- Алтухов К. В., Перекалин В. В. (1976). „Химия тетранитрометана”. 45 (11) (Успехи химии изд.): 2050—2076.
- Химическая энциклопедия в пяти томах. Пол — Три. 4. М.: «Большая Российская Энциклопедия». 1995. стр. 1102. ISBN 5-85270-092-4.
- Кантемиров Б. Н. (2012). Николай Гаврилович Чернышёв. М.: Наука. ISBN 978-5-02-037988-6.
- Нейланд О. Я. (1990). Органическая химия: Учеб. для хим. спец. вузов. М.: Высшая школа. ISBN 5-06-001471-1.
- Орлова Е. Ю. (1973). Химия и технология бризантных и взрывчатых веществ (2-е издание, переработанное и дополненное изд.). Л.: Химия.
- CRC Handbook of Chemistry and Physics (90th Edition изд.). CRC Press (Taylor and Francis Group). Ed. by D. R. Lide. 2009. ISBN 978-1-4200-9084-0.
- Urbansky T. (1964). Chemistry and Technology of Explosives. Vol. 1. Pergamon Press. ISBN 978-0080102382.
Spoljašnje veze
уреди- (језик: енглески) Tetranitromethane
- (језик: енглески) WebBook page for CN4O8
- (језик: енглески) CDC - NIOSH Pocket Guide to Chemical Hazards