Калцијум хлорид
Калцијум хлорид (CaCl2) је неорганско, јонско једињење калцијума и хлора. Веома је растворљиво у води. Ово је со, чврста на собној температури. Добија се директно из руде, али се велике количине овога једињења добијају и Солвејевим поступком. Ово је јако хигроскопно једињење. Гради ди, тетра и хексахидрате.
| |

| |
| Називи | |
|---|---|
| IUPAC назив
Калцијум хлорид
| |
| Други називи
Неутрални калцијум хлорид; калцијум(II) хлорид, калцијум дихлорид, E509
| |
| Идентификација | |
| |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.030.115 |
| EC број | 233-140-8 |
| Е-бројеви | E509 (регулатор киселости, ...) |
| RTECS | EV9800000 |
| UNII |
|
| |
| |
| Својства | |
| CaCl2 | |
| Моларна маса | 110,98 g·mol−1 |
| Агрегатно стање | Бели прах, хигроскопан |
| Мирис | Без мириса |
| Густина |
|
| Тачка топљења | 772 °C (1.422 °F; 1.045 K) анхидрат[7] 260 °C (500 °F; 533 K) монохидрат, разлаже се 175 °C (347 °F; 448 K) дихидрат, разлаже се 45,5 °C (113,9 °F; 318,6 K) тетрахидрат, разлаже се[7] 30 °C (86 °F; 303 K) хексахидрат, разлаже се[3] |
| Тачка кључања | 1.935 °C (3.515 °F; 2.208 K) анхидрат[3] |
| анхидрат: 74,5 g/100 mL (20 °C)[4] Хексахидрат: 49,4 g/100 mL (−25 °C) 59,5 g/100 mL (0 °C) 65 g/100 mL (10 °C) 81,1 g/100 mL (25 °C)[3] 102,2 g/100 mL (30.2 °C) α-Тетрахидрат: 90,8 g/100 mL (20 °C) 114,4 g/100 mL (40 °C) Дихидрат: 134,5 g/100 mL (60 °C) 152,4 g/100 mL (100 °C)[5] | |
| Растворљивост |
|
| Растворљивост у етанол |
|
| Растворљивост у метанол |
|
| Растворљивост у ацетон | 0,1 g/kg (20 °C)[6] |
| Растворљивост у пиридине | 16,6 g/kg[6] |
| Киселост (pKa) |
|
| Магнетна сусцептибилност | −5,47·10−5 cm³/mol[3] |
| Индекс рефракције (nD) | 1,52 |
| Вискозност |
|
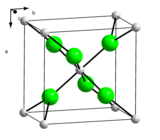
| Структура | |
| Кристална решетка/структура |
|
| Кристалографска група |
|
| |
a = 6,259 Å, b = 6,444 Å, c = 4,17 Å (анхидрат, 17 °C)[8] α = 90°, β = 90°, γ = 90°
| |
| Геометрија молекула | Октаедралан (Ca2+, анхидрат) |
| Термохемија | |
| Специфични топлотни капацитет, C | |
Стандардна моларна
ентропија (S |
108,4 J/mol·K[3][7] |
Стандардна енталпија
стварања (ΔfH |
|
Гибсова слободна енергија (ΔfG˚)
|
−748,81 kJ/mol[3][7] |
| Фармакологија | |
| A12AA07 (WHO) B05XA07, G04BA03 | |
| Опасности | |
| Главне опасности | Иритант |
| ГХС пиктограми |  [9] [9]
|
| ГХС сигналне речи | Упозорење |
| H319[9] | |
| P305+351+338[9] | |
| NFPA 704 | |
| Смртоносна доза или концентрација (LD, LC): | |
LD50 (средња доза)
|
1,000-1,400 mg/kg (пацови, орално)[10] |
| Сродна једињења | |
Други анјони
|
|
Други катјони
|
|
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Калцијум хлорид се често среће као хидратисана чврста супстанца са општом формулом CaCl2(H2O)x, где је x = 0, 1, 2, 4 и 6. Ова једињења се углавном користе за одлеђивање и контролу прашине. Будући да је безводна сол хигроскопна, користи се као средство за сушење.[12]
Хемијске особине
уредиКалцијум хлорид може да служи као донор јона калцијума у растворима пошто су многа једињења калцијума нерастворљива у води:
3 CaCl2(aq) + 2 K3PO4 (aq) → Ca3(PO4)2 (s) + 6 KCl (aq)
Из отопљеног CaCl2 се може путем електролизе добити метални калцијум:
Примена
уредиКалцијум хлорид се користи:
- у медицини као средство при недостатку калцијума
- за дехидратацију гасова
- за добијање различитих једињења калцијума
- за уклањање трагова воде из органских супстанци
- заједно са натријум хлоридом као средство за спречавање стварања леда на путевима
Припрема
уредиУ већем делу света калцијум хлорид се добија из кречњака као нуспроизвод Солвејевog поступка, који следи ову нето реакцију:[12]
- 2 NaCl + CaCO3 → Na2CO3 + CaCl2
Северноамеричка потрошња у 2002. години износила је 1.529.000 тона (3,37 милијарди фунти).[13]
У САД се већина калцијум хлорида добија пречишћавањем из слане воде.
Као и код већине ринфузних производа од соли, обично се јављају трагови осталих катјона алкалних метала и земноалкалних метала (групе 1 и 2) и других анјона из халогена (група 17), али концентрације су незнатне. Појава
Појава
уредиКалцијум хлорид се јавља у виду ретких евапоритних минерала сињарита (дихидрат) и антарктицит (хексахидрат).[14][15][16] Још један познати природни хидрат је гијарајит - тетрахидрат.[16][17] Сродни минерали хлорокалцит (калијум калцијум хлорид, KCaCl3) и тахихидрит (калцијум магнезијум хлорид, Ca Mg2Cl6·12H2O) су такође врло ретки.[16][18][19] То важи и за рорисит, CaClF (калцијум хлорид флуорид).[16][20]
Хазарди
уредиИако није токсичан у малим количинама када је влажан, изразито хигроскопна својства нехидратисане соли представљају извесну опасност. Калцијум хлорид може деловати надражујуће исушивањем влажне коже. Чврсти калцијум хлорид се егзотермно раствара, а опекотине се могу јавити и усној шупљини и једњаку ако се прогутају. Гутање концентрованих раствора или чврстих производа може проузроковати гастроинтестиналну иритацију или стварање чирева.[21]
Конзумација калцијум хлорида може довести до хиперкалцемије.[22]
Види још
уредиРеференце
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г д ђ е ж з Lide, David R., ур. (2009). CRC Handbook of Chemistry and Physics (90th изд.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ „Calcium chloride (anhydrous)”. ICSC. International Programme on Chemical Safety and the European Commission.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd изд.). New York: D. Van Nostrand Company. стр. 196.
- ^ а б в г д ђ Anatolievich, Kiper Ruslan. „Properties of substance: calcium chloride”. chemister.ru. Приступљено 2014-07-07.
- ^ а б в г д ђ Pradyot, Patnaik (2019). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. стр. 162. ISBN 978-0-07-049439-8.
- ^ а б в г Müller, Ulrich (2006). Inorganic Structural Chemistry. wiley.com (2nd изд.). England: John Wiley & Sons Ltd. стр. 33. ISBN 978-0-470-01864-4.
- ^ а б в Sigma-Aldrich Co. Retrieved on 2014-07-07.
- ^ Donald E. Garrett (2004). Handbook of Lithium and Natural Calcium Chloride. Elsevier. стр. 379. ISBN 978-0080472904. Приступљено 29. 08. 2018. „Its toxicity upon ingestion, is indicated by the test on rats: oral LD50 (rat) is 1.0–1.4 g/kg (the lethal dose for half of the test animals, in this case rats...)”
- ^ „MSDS of Calcium chloride”. fishersci.ca. Fisher Scientific. Приступљено 2014-07-07.
- ^ а б Kemp, Robert; Keegan, Suzanne E. (2000). „Calcium Chloride”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 978-3-527-30385-4. doi:10.1002/14356007.a04_547.
- ^ Calcium Chloride SIDS Initial Assessment Profile, UNEP Publications, SIAM 15, Boston, 22–25 October 2002, page 11.
- ^ „Sinjarite”.
- ^ „Antarcticite”.
- ^ а б в г List of Minerals
- ^ „Ghiaraite”.
- ^ „Chlorocalcite”.
- ^ „Tachyhydrite”.
- ^ „Rorisite”.
- ^ „Product Safety Assessment (PSA): Calcium Chloride”. Dow Chemical Company. 2. 5. 2006. Архивирано из оригинала 17. 9. 2009. г. Приступљено 22. 7. 2008.
- ^ „Calcium Chloride Possible Side Affects”. Архивирано из оригинала 27. 07. 2020. г. Приступљено 01. 05. 2021.
Литература
уреди- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
Додатна литература
уреди- „Difusivity of calcium chloride”. doi:10.1021/ja01131a021.
Спољашње везе
уреди- International Chemical Safety Card 1184 Архивирано 2013-04-15 на сајту Archive.today
- Product and Application Information (Formerly Dow Chemical Calcium Chloride division) Архивирано на сајту Wayback Machine (17. септембар 2023)
- „Report on steel corrosion by chloride including CaCl2” (PDF). Архивирано из оригинала (PDF) 16. 06. 2011. г.
- „Collection of calcium chloride reports and articles”. Архивирано из оригинала 06. 02. 2009. г.
- „Calcium chloride, Anhydrous MSDS”. Архивирано из оригинала 15. 10. 2012. г.
- Centers for Disease Control and Prevention, National Institutes of Occupational Safety and Health, "Calcium Chloride (anhydrous)"
