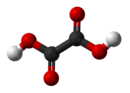
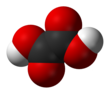
Oksalna kiselina
Oksalna kiselina je organsko jedinjenje sa formulom H2C2O4. Ova bezbojna čvrsta materija je dikarboksulna kiselina. U pogledu jačine kiseline, ona je oko 3,000 puta jača od sirćetne kiseline. Oksalna kiselina je redukujući agens. Njena konjugovana baza, poznata kao oksalat (C2O42−), je helirajući agens metalnih katjona. Oksalna kiseline se tipično javlja kao dihidrat sa formulom H2C2O4·2H2O.

| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Etandionska kiselina
| |||
| Drugi nazivi
Oksalna kiselina
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| 3DMet | B00059 | ||
| Bajlštajn | 385686 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.123 | ||
| EC broj | 205-634-3 | ||
| Gmelin Referenca | 2208 | ||
| KEGG[1] | |||
| MeSH | Oxalic+acid | ||
| RTECS | RO2450000 | ||
| UNII | |||
| UN broj | 3261 | ||
| |||
| Svojstva | |||
| C2H2O4 | |||
| Molarna masa | 90,03 g·mol−1 | ||
| Agregatno stanje | Beli kristali | ||
| Gustina | 1,90 g cm-3 | ||
| 90 g dm-3 (na 20 °C) | |||
| Kiselost (pKa) | 1.25, 4.14[4] | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | Eksterni MSDS | ||
| NFPA 704 | |||
| Tačka paljenja | 166 °C | ||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
oksalil hlorid dinatrijum oksalat kalcijum oksalat fenil oksalatni estar | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Priprema
уредиOksalna kiselina se uglavnom proizvodi oksidacijom ugljenih hidrata ili glukoze koristeći azotnu kiselinu, ili vazduh u prisustvu vanadijum pentoksida. Mnoštvo prekurzora se može koristiti među kojima su glikolna kiselina i etilen glikol.[5] Noviji metod se sastoji od oksidativne karbonilacije alkohola kojom se formiraju diesteri oksalne kiseline:
Ovi diestri se naknadno hidrolizuju do oksalne kiseline. Oko 120,000 metričkih tona se proizvede godišnje.[6]
Laboratorijski metodi
уредиOksalna kiselina se može pripremiti u laboratoriji oksidacijom saharoze koristeći azotnu kiselinu u prisustvu male količine vanadijum pentoksida kao katalizatora.[7]
Hidratisani kristali se mogu dehidratisati zagrevanjem ili putem azeotropne destilacije.[8]
Struktura
уредиAnhidratna oksalna kiselina postoji u obliku dva polimorfa. U jednom vodonično vezivanje rezultuje u lančastoj strukturi, dok način vodoničnog vezivanje drugog oblika uslovljava pločastu strukturu.[9] Anhidratni materijal kiseo i hidrofilan, te se koristi u esterifikacijama.
Reference
уреди- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.
- ^ Process for the production of oxalic acid
- ^ Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005.
- ^ Practical Organic Chemistry by Julius B. Cohen, 1930 ed. preparation #42
- ^ Clarke H. T.;. Davis, A. W. (1941). „Oxalic acid (anhydrous)”. Org. Synth.: 421.; Coll. Vol., 1
- ^ Wells, A.F. (1984) Structural inorganic chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
Spoljašnje veze
уреди- Интернационална карта хемијске безбедности 0529
- „Oxalic acid”. ChemicalLand21.com. Архивирано из оригинала 30. 01. 2012. г. Приступљено 25. 01. 2012.
- Sadržaj oksalne kiseline u povrću