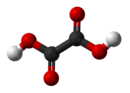
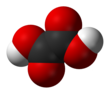
Оксална киселина
Оксална киселина је органско једињење са формулом H2C2O4. Ова безбојна чврста материја је дикарбоксулна киселина. У погледу јачине киселине, она је око 3,000 пута јача од сирћетне киселине. Оксална киселина је редукујући агенс. Њена коњугована база, позната као оксалат (C2O42−), је хелирајући агенс металних катјона. Оксална киселине се типично јавља као дихидрат са формулом H2C2O4·2H2O.

| |||
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Etandionska kiselina
| |||
| Други називи
Оксална киселина
| |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| 3DMet | Б00059 | ||
| Бајлштајн | 385686 | ||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.005.123 | ||
| EC број | 205-634-3 | ||
| Гмелин Референца | 2208 | ||
| КЕГГ[1] | |||
| МеСХ | Оxалиц+ацид | ||
| RTECS | РО2450000 | ||
| УНИИ | |||
| УН број | 3261 | ||
| |||
| Својства | |||
| C2H2O4 | |||
| Моларна маса | 90,03 g·mol−1 | ||
| Агрегатно стање | Бели кристали | ||
| Густина | 1,90 g cm-3 | ||
| 90 g dm-3 (на 20 °C) | |||
| Киселост (пКа) | 1.25, 4.14[4] | ||
| Опасности | |||
| Безбедност приликом руковања | Екстерни MSDS | ||
| НФПА 704 | |||
| Тачка паљења | 166 °C | ||
| Сродна једињења | |||
Сродна једињења
|
оксалил хлорид динатријум оксалат калцијум оксалат фенил оксалатни естар | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Припрема
уредиОксална киселина се углавном производи оксидацијом угљених хидрата или глукозе користећи азотну киселину, или ваздух у присуству ванадијум пентоксида. Мноштво прекурзора се може користити међу којима су гликолна киселина и етилен гликол.[5] Новији метод се састоји од оксидативне карбонилације алкохола којом се формирају диестери оксалне киселине:
Ови диестри се накнадно хидролизују до оксалне киселине. Око 120,000 метричких тона се произведе годишње.[6]
Лабораторијски методи
уредиОксална киселина се може припремити у лабораторији оксидацијом сахарозе користећи азотну киселину у присуству мале количине ванадијум пентоксида као катализатора.[7]
Хидратисани кристали се могу дехидратисати загревањем или путем азеотропне дестилације.[8]
Структура
уредиАнхидратна оксална киселина постоји у облику два полиморфа. У једном водонично везивање резултује у ланчастој структури, док начин водоничног везивање другог облика условљава плочасту структуру.[9] Анхидратни материјал кисео и хидрофилан, те се користи у естерификацијама.
Референце
уреди- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.
- ^ Process for the production of oxalic acid
- ^ Уллманн’с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. 2005.
- ^ Practical Organic Chemistry by Julius B. Cohen, 1930 ed. preparation #42
- ^ Clarke H. T.;. Davis, A. W. (1941). „Oxalic acid (anhydrous)”. Org. Synth.: 421.; Coll. Vol., 1
- ^ Wells, A.F. (1984) Structural inorganic chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
Спољашње везе
уреди- Интернационална карта хемијске безбедности 0529
- „Оxалиц ацид”. ЦхемицалЛанд21.цом. Архивирано из оригинала 30. 01. 2012. г. Приступљено 25. 01. 2012.
- Садржај оксалне киселине у поврћу