Gliom
Gliom je tip tumora koji raste u glijalnim ćelijama mozga i kičme.[тражи се извор] Gliomi obuhvataju oko 30% svih tumora mozga i tumora centralnog nervnog sistema i 80% svih malignih tumora mozga.[1]
| Gliom | |
|---|---|
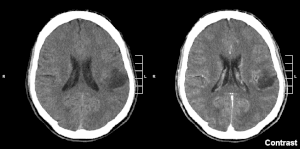 | |
| Gliom u levom parietalnom režnju (CT snimak mozga), SZO stepen 2. | |
| Specijalnosti | Onkologija |
Znaci i simptomi oboljenja
уредиSimptomi glioma zavise od toga koji je deo centralnog nervnog sistema zahvaćen. Gliom mozga može izazvati glavobolje, povraćanje, poremećaje kranijalnog nerva kao rezultat povećanog intrakranijalnog pritiska. Gliom optičkog nerva može izazvati gubitak vida. Gliomi kičmene moždine mogu uzrokovati bol, slabost ili obamrlost u ekstremitetima. Gliomi se obično ne metastaziraju krvotokom, ali se mogu širiti preko cerebrospinalne tečnosti i uzrokovati "pad metastaze" u kičmenu moždinu. Dete koje ima subakutni poremećaj centralnog nervnog sistema koji proizvodi abnormalnosti kranijalnog nerva (posebno kranijalnog nerva VII i donjih bulbarnih živaca), znakove dugog trakta, nestacionarni hod koji je sekundaran spastičnosti i neke promjene u ponašanju najvjerovatnije potiče od glioma.[2]
Uzroci
уредиPravi uzroci glioma nisu poznati i potvrđeni, ali postoje faktori koji doprinose nastanku.
Nasledni poremećaji
уредиNasledni poremećaji kao što su neurofibromatoze (tip 1 i tip 2), koje predstavljaju geneteske poremećaje pri kojima se ometa rad i nastajanje ćelija, i kompleks tuberozne skleroze[3]kao multisistemska progresivna bolest koja izaziva nastajanje benignih tumora brojnih organa, poznate su kao predispozicije za razvoj glioma. [4]
Različiti onkogeni (potencijalni je gen koji može biti uzrok kancera) mogu doprinositi razvoju glioma.[5]
Ishrana
уредиNeke studije ishrane i suplementacije vitamina ukazuju na to da prehrambeni N-nitrozni spojevi (hemijska jedinjenja sa hemijskom formulom R1N(–R2)–N=O) mogu uticati na rizik i od tumora mozga u detinjstvu i odraslih. Istraživači su u svojim istraživanjima primetili da pacijenti sa tumorima mozga (ili njihove majke, jer je kancer genetski predisponovan) uglavnom konzumiraju više konzervisane hrane nego kontrolne grupe. [6]
Drs. Lee, Vrensch i drugi su ljudi koji su otkrili da odrasli sa gliomom češće primenjuju dijete sa visokim sadržajem suve hrane i malo voća i povrća bogatog vitaminom C, kao i da konzumiraju dijete sa visokim sadržajem nitrita i malo vitamina C. Efekat je bio izraženiji kod muškaraca nego žena (Epidemiologija: vrsta tumora-gliom izraženija kod osoba muškog pola).
Međutim, obrazac povećanog rizika sa povećanom potrošnjom suvih namirnica i smanjenim rizikom od veće konzumacije voća, povrća i antioksidativnih vitamina kompatibilan je sa drugim studijama o raku koje pokazuju da je povećana potrošnja povrća i voća povezana sa smanjenim rizikom od nastanka raka.[тражи се извор]
Radijacija
уредиGliomi su povezani sa elektromagnetnim zračenjem iz mobilnih telefona, a veza između nastajanja raka i upotrebe mobilnih telefona smatrana je mogućom,[7]iako je nekoliko velikih studija otkrilo da nema zaključnih dokaza, kao što je rezimirao Nacionalni institut za rak NIH-a i njeni brojni citati i FCC. [8]Uprkos dosadašnjim otkrićima, i dalje se nastavljaju istraživanja kako bi se dobili još snažniji dokazi i potvrdilo se da nema nikakve veze (najnovije saopštenje NIH-a iz Nacionalnog instituta za zdravstvene nauke o okolini raspravljalo je o tekućoj studiji[9] koja pokazuje blago pozitivne rezultate).[10]
Infekcija sa citomegalovirusom
уредиVećina glioblastoma je inficirana humanim citomegalovirusom, koji ubrzava razvoj tumora.[11]
Drugi uzroci
уредиProfesionalna orijentacija
уредиIako su neke studije pokazale da farmeri imaju veće stope glioma u poređenju sa opštom populacijom, izlaganje životinjama na farmi nije povezano sa gliomom.[12]Kasnije studije nisu pronašle povezanost između uzgoja i glioma; slični konfliktni podaci odnose se na nastavnike i gliom. Konzistentniji podaci pokazuju da arhitekte, geodeti, mesari i inženjeri imaju veće stope rizika od nastajanja glioma.[13]Većina studija je pokazala da izlaganje pesticidima nije uzrok glioma, iako je manji broj studija našao povezanost.[13]
Nasleđeni polimorfizmi gena
уредиPolimorfizmi genske linije (nasledni) polimorfizama DNK popravnih gena ERCC1, ERCC2 (KSPD) i KSRCC1 povećavaju rizik od glioma. Ovo ukazuje da izmenjeno ili nedovoljno popravljeno oštećenje DNK doprinosi formiranju glioma. Oštećenja DNK su verovatno glavni primarni uzrok progresije raka uopšte. Oštećenja viška DNK mogu dovesti do mutacija kroz sintezu transleziona. Štaviše, nepotpuna popravka DNK može dovesti do epigenetskih promena ili epimutacija.[14]Takve mutacije i epimutacije mogu da obezbede ćeliju sa proliferativnom prednošću koja onda može, procesom prirodne selekcije, dovesti do progresije do raka. Epigenetska represija gena za popravak DNK se često nalazi u progresiji do sporadičnog glioblastoma. Na primer, metilacija promotorskog gena DNA MGMT promotora je primećena u 51% do 66% uzoraka glioblastoma.[15]Pored toga, kod nekih glioblastoma, MGMT protein je manjkav zbog drugog tipa epigenetske alteracije. Ekspresija MGMT proteina takođe može biti smanjena zbog povećanih nivoa mikroRNK koja inhibira sposobnost RNK MGMT da proizvodi MGMT protein. Zhang et al.[16] u glioblastomima bez metiliranih MGMT promotora, da je nivo mikroRNA miR-181d obrnuto koreliran sa ekspresijom MGMT proteina i da je direktna meta miR-181d MGMT mRNA 3'UTR (tri proste netranslatovane regije MGMT RNA). Epigenetske redukcije ekspresije drugog proteina za popravku DNK, ERCC1, nađene su u asortimanu od 32 glioma. Za 17 od 32 (53%) testiranih glioma, ekspresija ERCC1 proteina je smanjena ili je izostala. U slučaju 12 glioma (37,5%) ovo smanjenje je bilo rezultat metilacije ERCC1 promotora. Za ostalih 5 glioma sa smanjenom ekspresijom ERCC1 proteina, redukcija je mogla biti posledica epigenetskih promena u mikroRNK koje utiču na ekspresiju ERCC1. Kada se smanjuje ekspresija gena za popravak DNK, oštećenja DNK se akumuliraju u ćelijama na višem nivou od normalnog, i takva viška oštećenja prouzrokuje povećane frekvencije mutacije.[17]
Patofiziologija
уредиVisokokvalitetni gliomi su vaskularni tumori i imaju tendenciju infiltriranja. Postoje obimne oblasti nekroze i hipoksije (nedostatak kiseonika u crvenim krvnim ćelijama). Često, rast tumora uzrokuje propadanje krvno-moždane barijere u blizini tumora. Po pravilu, veliki broj glioma skoro uvek raste i nakon kompletne hirurške ekscizije, pa se obično nazivaju rekurentni rak mozga. Nasuprot tome, gliomi niskog stepena rastu sporo, tokom mnogih godina, i mogu se pratiti bez tretmana, osim ako ne rastu i izazivaju simptome. Nekoliko stečenih (ne nasleđenih) genetičkih mutacija pronađeno je u gliomima. Protein supresor tumora 53 (p53) mutiran je u ranoj fazi bolesti. p53 je "čuvar genoma", koji tokom dupliciranja DNK i ćelija osigurava da se DNK kopira ispravno i uništava ćeliju (apoptoza) ako je DNK mutirana i ne može biti fiksirana. Kada je sama p53 mutirana, druge mutacije mogu preživjeti. Fosfataza i tenzinski homolog (PTEN), drugi tumorski supresorski gen, je sam izgubljen ili mutiran. Receptor epidermalnog faktora rasta, faktor rasta koji normalno stimuliše ćelije da se dele, pojačava se i stimuliše ćelije da se previše podele. Zajedno, ove mutacije dovode do nekontroliranog dijeljenja stanica, što je znak raka. Nedavno je utvrđeno da su mutacije u IDH1 i IDH2 deo mehanizma i povezane sa povoljnijom prognozom.[18]
Lečenje
уредиLečenje glioma u mozgu zavisi od lokacije, tipa ćelije i stepena maligniteta. Često se primenjuju kombinovano lečenje, upotreba hirurške intervencije, radioterapija i hemoterapija. Radioterapija je u vidu spoljašnjeg zračenja ili stereotaktičkog pristupa koji se vrši pomoću radiohirurgije. Tumori kičmene moždine mogu se lečiti hirurškim putem i zračenjem, u zavisnosti od faze oboljenja. Temozolomid, hemoterapijski lek, je u stanju da efikasno transcendira krvno-moždanu barijeru i trenutno se koristi u terapiji visokog stepena tumora.
Refraktorna bolest
уредиZa visoko kvalitetne rekurentne glioblastome, nedavna istraživanja su koristila angiogene blokatore kao što je, na primer, bevacizumab u kombinaciji sa konvencionalnom hemoterapijom, uz ohrabrujuće rezultate. Meta-analiza u 2017. uporedila je hiruršku resekciju sa biopsijom kao početnu opciju hirurškog tretmana za bolesnike sa niskim stadijumom tumora glioma. Rezultati pokazuju da su dokazi nedovoljni za donošenje pouzdane odluke. Relativna efikasnost hirurške resekcije u poređenju sa biopsijom kod osoba sa malignim gliomom (visok stepen) nije poznata. Za visokokvalitetne gliome, meta-analiza iz 2003. godine uporedila je radioterapiju sa radioterapijom i hemoterapijom. Pokazalo je malo ali jasno poboljšanje u odnosu na upotrebu hemoterapije sa radioterapijom. Temozolomid je efikasan u lečenju Glioblastoma Multiforme (GBM) u poređenju sa samom radioterapijom. Meta-analiza 2013. pokazala je da Temozolomid produžava preživljavanje i odgađa napredovanje, ali je povezan sa povećanjem neželjenih efekata kao što su komplikacije krvi, umor i infekcija. Kod osoba sa rekurentnim GBM, kada se temozolomid upoređuje sa hemoterapijom, može doći do poboljšanja u vremenu do napredovanja i kvaliteta života osobe, ali bez poboljšanja ukupnog preživljavanja, uz terapiju temozolomidom. Mutaciona analiza 23 glioma sa početnim niskim i rekurentnim tumorima kod istih pacijenata dovela je u pitanje upotrebu i upotrebu Temozolomida. Studija je pokazala da kada su uklonjeni tumori mozga nižih klasa pacijenata i da su pacijenti dalje lečeni Temozolomidom, 6 od 10 puta su rekurentni tumori bili agresivniji i dobijali alternativne i više mutacija. Kako je jedan od poslednjih autora, Costello, rekao: "Imali su 20 do 50 puta više mutacija. Pacijent koji je sam primio operaciju i koji je možda imao 50 mutacija u početnom tumoru i 60 u relapsu, pacijenti koji su primili TMZ moglo bi imati 2.000 mutacija u recidivu. "[тражи се извор] Nadalje, potvrđene su nove mutacije koje nose poznate potpise mutacija temozolomida. Studija sugerira da tiazolomid treba temeljno razmotriti za liječenje određenih tumora mozga. Neopravdana upotreba Temozolomida može dodatno smanjiti prognozu ili povećati opterećenje pacijenta. Dalja razumijevanja mehanizma mutacije indukovane temozolomidom i nove kombinacije mogu biti obećavajuća.
Reference
уреди- ^ Mamelak, Adam N.; Jacoby, Douglas B. (1. 3. 2007). „Targeted delivery of antitumoral therapy to glioma and other malignancies with synthetic chlorotoxin (TM-601)”. Expert Opinion on Drug Delivery. 4 (2): 175—186. ISSN 1742-5247. PMID 17335414. doi:10.1517/17425247.4.2.175.
- ^ „Simptomi tumora” (PDF). Архивирано из оригинала (PDF) 23. 11. 2018. г.
- ^ Radner, H.; el-Shabrawi, Y.; Eibl, R. H.; Brüstle, O.; Kenner, L.; Kleihues, P.; Wiestler, O. D. (1993). „Tumor induction by ras and myc oncogenes in fetal and neonatal brain: modulating effects of developmental stage and retroviral dose”. Acta Neuropathologica. 86 (5): 456—465. ISSN 0001-6322. PMID 8310796.
- ^ Reuss, David; von Deimling, Andreas (2009). „Hereditary tumor syndromes and gliomas”. Recent Results in Cancer Research. Fortschritte Der Krebsforschung. Progres Dans Les Recherches Sur Le Cancer. 171: 83—102. ISSN 0080-0015. PMID 19322539. doi:10.1007/978-3-540-31206-2_5.
- ^ „Onkogen” (PDF). Архивирано из оригинала (PDF) 23. 11. 2018. г.
- ^ „Gliom”. Stetoskop.info (на језику: српски). Архивирано из оригинала 03. 12. 2020. г. Приступљено 26. 7. 2019.
- ^ „Radijacija” (PDF).
- ^ „Cell Phones and Cancer Risk Fact Sheet”. National Cancer Institute (на језику: енглески). 14. 1. 2019. Приступљено 26. 7. 2019.
- ^ „Media Telebriefing: NTP Cell Phone Radiofrequency Radiation Study: Partial Release of Findings”. National Institute of Environmental Health Sciences (на језику: енглески). Архивирано из оригинала 09. 07. 2019. г. Приступљено 26. 7. 2019.
- ^ CNN, Carina Storrs, for. „Cell phone-related cancer for rats raises alarm”. CNN. Приступљено 26. 7. 2019.
- ^ Michaelis, Martin; Baumgarten, Peter; Mittelbronn, Michel; Driever, Pablo Hernáiz; Doerr, Hans Wilhelm; Cinatl, Jindrich (2011). „Oncomodulation by human cytomegalovirus: novel clinical findings open new roads”. Medical Microbiology and Immunology. 200 (1): 1—5. ISSN 1432-1831. PMID 20967552. doi:10.1007/s00430-010-0177-7.
- ^ Dziurzynski, Kristine; Chang, Susan M.; Heimberger, Amy B.; Kalejta, Robert F.; McGregor Dallas, Stuart R.; Smit, Martine; Soroceanu, Liliana; Cobbs, Charles S. (2012). „Consensus on the role of human cytomegalovirus in glioblastoma”. Neuro-Oncology. 14 (3): 246—255. ISSN 1522-8517. PMC 3280809 . PMID 22319219. doi:10.1093/neuonc/nor227.
- ^ а б Ostrom, Quinn T.; Bauchet, Luc; Davis, Faith G.; Deltour, Isabelle; Fisher, James L.; Langer, Chelsea Eastman; Pekmezci, Melike; Schwartzbaum, Judith A.; Turner, Michelle C. (2014). „The epidemiology of glioma in adults: a “state of the science” review”. Neuro-Oncology. 16 (7): 896—913. ISSN 1522-8517. PMC 4057143 . PMID 24842956. doi:10.1093/neuonc/nou087.
- ^ Cuozzo, Concetta; Porcellini, Antonio; Angrisano, Tiziana; Morano, Annalisa; Lee, Bongyong; Pardo, Alba Di; Messina, Samantha; Iuliano, Rodolfo; Fusco, Alfredo (2007). „DNA Damage, Homology-Directed Repair, and DNA Methylation”. PLoS Genetics. 3 (7). ISSN 1553-7390. PMC 1913100 . PMID 17616978. doi:10.1371/journal.pgen.0030110.
- ^ Skiriute, Daina; Vaitkiene, Paulina; Saferis, Viktoras; Asmoniene, Virginija; Skauminas, Kestutis; Deltuva, Vytenis Pranas; Tamasauskas, Arimantas (6. 6. 2012). „MGMT, GATA6, CD81, DR4, and CASP8 gene promoter methylation in glioblastoma”. BMC Cancer. 12: 218. ISSN 1471-2407. PMC 3404983 . PMID 22672670. doi:10.1186/1471-2407-12-218.
- ^ „Neuro-Oncology | Oxford Academic”. Oxford University Press Academic (на језику: енглески). Приступљено 26. 7. 2019.
- ^ Narayanan, Latha; Fritzell, James A.; Baker, Sean M.; Liskay, R. Michael; Glazer, Peter M. (1. 4. 1997). „Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2”. Proceedings of the National Academy of Sciences of the United States of America. 94 (7): 3122—3127. ISSN 0027-8424. PMID 9096356.
- ^ Seizinger, Bernd R.; Wiestler, Otmar D.; Chung, Richard Y.; Kleihues, Paul; Petersen, Iver; Ammon, Klaus von; Louis, David N.; Ohgaki, Hiroko; Eibl, Robert H. (15. 5. 1992). „p53 Mutations Are Associated with 17p Allelic Loss in Grade II and Grade III Astrocytoma”. Cancer Research (на језику: енглески). 52 (10): 2987—2990. ISSN 0008-5472. PMID 1349850. Архивирано из оригинала 26. 07. 2019. г. Приступљено 26. 07. 2019.
Spoljašnje veze
уреди| Klasifikacija |
|---|
- Glioma at the Human Protein Atlas
- American Brain Tumor Association: Malignant Gliomas
- Brain and Spinal Tumors: Hope Through Research (National Institute of Neurological Disorders and Stroke)
- WHO Classification of Glioma
- Glioma Images MedPix Database
| Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |