Глиом
Глиом је тип тумора који расте у глијалним ћелијама мозга и кичме.[тражи се извор] Глиоми обухватају око 30% свих тумора мозга и тумора централног нервног система и 80% свих малигних тумора мозга.[1]
| Глиом | |
|---|---|
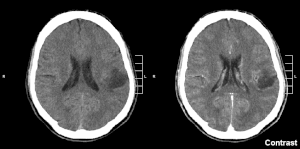 | |
| Глиом у левом париеталном режњу (ЦТ снимак мозга), СЗО степен 2. | |
| Специјалности | Онкологија |
Знаци и симптоми обољења
уредиСимптоми глиома зависе од тога који је део централног нервног система захваћен. Глиом мозга може изазвати главобоље, повраћање, поремећаје кранијалног нерва као резултат повећаног интракранијалног притиска. Глиом оптичког нерва може изазвати губитак вида. Глиоми кичмене мождине могу узроковати бол, слабост или обамрлост у екстремитетима. Глиоми се обично не метастазирају крвотоком, али се могу ширити преко цереброспиналне течности и узроковати "пад метастазе" у кичмену мождину. Дете које има субакутни поремећај централног нервног система који производи абнормалности кранијалног нерва (посебно кранијалног нерва VII и доњих булбарних живаца), знакове дугог тракта, нестационарни ход који је секундаран спастичности и неке промјене у понашању највјероватније потиче од глиома.[2]
Узроци
уредиПрави узроци глиома нису познати и потврђени, али постоје фактори који доприносе настанку.
Наследни поремећаји
уредиНаследни поремећаји као што су неурофиброматозе (тип 1 и тип 2), које представљају генетеске поремећаје при којима се омета рад и настајање ћелија, и комплекс туберозне склерозе[3]као мултисистемска прогресивна болест која изазива настајање бенигних тумора бројних органа, познате су као предиспозиције за развој глиома. [4]
Различити онкогени (потенцијални је ген који може бити узрок канцера) могу доприносити развоју глиома.[5]
Исхрана
уредиНеке студије исхране и суплементације витамина указују на то да прехрамбени Н-нитрозни спојеви (хемијска једињења са хемијском формулом Р1Н(–Р2)–Н=О) могу утицати на ризик и од тумора мозга у детињству и одраслих. Истраживачи су у својим истраживањима приметили да пацијенти са туморима мозга (или њихове мајке, јер је канцер генетски предиспонован) углавном конзумирају више конзервисане хране него контролне групе. [6]
Дрс. Лее, Вренсцх и други су људи који су открили да одрасли са глиомом чешће примењују дијете са високим садржајем суве хране и мало воћа и поврћа богатог витамином C, као и да конзумирају дијете са високим садржајем нитрита и мало витамина C. Ефекат је био израженији код мушкараца него жена (Епидемиологија: врста тумора-глиом израженија код особа мушког пола).
Међутим, образац повећаног ризика са повећаном потрошњом сувих намирница и смањеним ризиком од веће конзумације воћа, поврћа и антиоксидативних витамина компатибилан је са другим студијама о раку које показују да је повећана потрошња поврћа и воћа повезана са смањеним ризиком од настанка рака.[тражи се извор]
Радијација
уредиГлиоми су повезани са електромагнетним зрачењем из мобилних телефона, а веза између настајања рака и употребе мобилних телефона сматрана је могућом,[7]иако је неколико великих студија открило да нема закључних доказа, као што је резимирао Национални институт за рак НИХ-а и њени бројни цитати и ФЦЦ. [8]Упркос досадашњим открићима, и даље се настављају истраживања како би се добили још снажнији докази и потврдило се да нема никакве везе (најновије саопштење НИХ-а из Националног института за здравствене науке о околини расправљало је о текућој студији[9] која показује благо позитивне резултате).[10]
Инфекција са цитомегаловирусом
уредиВећина глиобластома је инфицирана хуманим цитомегаловирусом, који убрзава развој тумора.[11]
Други узроци
уредиПрофесионална оријентација
уредиИако су неке студије показале да фармери имају веће стопе глиома у поређењу са општом популацијом, излагање животињама на фарми није повезано са глиомом.[12]Касније студије нису пронашле повезаност између узгоја и глиома; слични конфликтни подаци односе се на наставнике и глиом. Конзистентнији подаци показују да архитекте, геодети, месари и инжењери имају веће стопе ризика од настајања глиома.[13]Већина студија је показала да излагање пестицидима није узрок глиома, иако је мањи број студија нашао повезаност.[13]
Наслеђени полиморфизми гена
уредиПолиморфизми генске линије (наследни) полиморфизама ДНК поправних гена ЕРЦЦ1, ЕРЦЦ2 (КСПД) и КСРЦЦ1 повећавају ризик од глиома. Ово указује да измењено или недовољно поправљено оштећење ДНК доприноси формирању глиома. Оштећења ДНК су вероватно главни примарни узрок прогресије рака уопште. Оштећења вишка ДНК могу довести до мутација кроз синтезу транслезиона. Штавише, непотпуна поправка ДНК може довести до епигенетских промена или епимутација.[14]Такве мутације и епимутације могу да обезбеде ћелију са пролиферативном предношћу која онда може, процесом природне селекције, довести до прогресије до рака. Епигенетска репресија гена за поправак ДНК се често налази у прогресији до спорадичног глиобластома. На пример, метилација промоторског гена ДНА МГМТ промотора је примећена у 51% до 66% узорака глиобластома.[15]Поред тога, код неких глиобластома, МГМТ протеин је мањкав због другог типа епигенетске алтерације. Експресија МГМТ протеина такође може бити смањена због повећаних нивоа микроРНК која инхибира способност РНК МГМТ да производи МГМТ протеин. Зханг ет ал.[16] у глиобластомима без метилираних МГМТ промотора, да је ниво микроРНА миР-181д обрнуто корелиран са експресијом МГМТ протеина и да је директна мета миР-181д МГМТ мРНА 3'УТР (три просте нетранслатоване регије МГМТ РНА). Епигенетске редукције експресије другог протеина за поправку ДНК, ЕРЦЦ1, нађене су у асортиману од 32 глиома. За 17 од 32 (53%) тестираних глиома, експресија ЕРЦЦ1 протеина је смањена или је изостала. У случају 12 глиома (37,5%) ово смањење је било резултат метилације ЕРЦЦ1 промотора. За осталих 5 глиома са смањеном експресијом ЕРЦЦ1 протеина, редукција је могла бити последица епигенетских промена у микроРНК које утичу на експресију ЕРЦЦ1. Када се смањује експресија гена за поправак ДНК, оштећења ДНК се акумулирају у ћелијама на вишем нивоу од нормалног, и таква вишка оштећења проузрокује повећане фреквенције мутације.[17]
Патофизиологија
уредиВисококвалитетни глиоми су васкуларни тумори и имају тенденцију инфилтрирања. Постоје обимне области некрозе и хипоксије (недостатак кисеоника у црвеним крвним ћелијама). Често, раст тумора узрокује пропадање крвно-мождане баријере у близини тумора. По правилу, велики број глиома скоро увек расте и након комплетне хируршке ексцизије, па се обично називају рекурентни рак мозга. Насупрот томе, глиоми ниског степена расту споро, током многих година, и могу се пратити без третмана, осим ако не расту и изазивају симптоме. Неколико стечених (не наслеђених) генетичких мутација пронађено је у глиомима. Протеин супресор тумора 53 (п53) мутиран је у раној фази болести. п53 је "чувар генома", који током дуплицирања ДНК и ћелија осигурава да се ДНК копира исправно и уништава ћелију (апоптоза) ако је ДНК мутирана и не може бити фиксирана. Када је сама п53 мутирана, друге мутације могу преживјети. Фосфатаза и тензински хомолог (ПТЕН), други туморски супресорски ген, је сам изгубљен или мутиран. Рецептор епидермалног фактора раста, фактор раста који нормално стимулише ћелије да се деле, појачава се и стимулише ћелије да се превише поделе. Заједно, ове мутације доводе до неконтролираног дијељења станица, што је знак рака. Недавно је утврђено да су мутације у ИДХ1 и ИДХ2 део механизма и повезане са повољнијом прогнозом.[18]
Лечење
уредиЛечење глиома у мозгу зависи од локације, типа ћелије и степена малигнитета. Често се примењују комбиновано лечење, употреба хируршке интервенције, радиотерапија и хемотерапија. Радиотерапија је у виду спољашњег зрачења или стереотактичког приступа који се врши помоћу радиохирургије. Тумори кичмене мождине могу се лечити хируршким путем и зрачењем, у зависности од фазе обољења. Темозоломид, хемотерапијски лек, је у стању да ефикасно трансцендира крвно-мождану баријеру и тренутно се користи у терапији високог степена тумора.
Рефракторна болест
уредиЗа високо квалитетне рекурентне глиобластоме, недавна истраживања су користила ангиогене блокаторе као што је, на пример, бевацизумаб у комбинацији са конвенционалном хемотерапијом, уз охрабрујуће резултате. Мета-анализа у 2017. упоредила је хируршку ресекцију са биопсијом као почетну опцију хируршког третмана за болеснике са ниским стадијумом тумора глиома. Резултати показују да су докази недовољни за доношење поуздане одлуке. Релативна ефикасност хируршке ресекције у поређењу са биопсијом код особа са малигним глиомом (висок степен) није позната. За висококвалитетне глиоме, мета-анализа из 2003. године упоредила је радиотерапију са радиотерапијом и хемотерапијом. Показало је мало али јасно побољшање у односу на употребу хемотерапије са радиотерапијом. Темозоломид је ефикасан у лечењу Глиобластома Мултиформе (ГБМ) у поређењу са самом радиотерапијом. Мета-анализа 2013. показала је да Темозоломид продужава преживљавање и одгађа напредовање, али је повезан са повећањем нежељених ефеката као што су компликације крви, умор и инфекција. Код особа са рекурентним ГБМ, када се темозоломид упоређује са хемотерапијом, може доћи до побољшања у времену до напредовања и квалитета живота особе, али без побољшања укупног преживљавања, уз терапију темозоломидом. Мутациона анализа 23 глиома са почетним ниским и рекурентним туморима код истих пацијената довела је у питање употребу и употребу Темозоломида. Студија је показала да када су уклоњени тумори мозга нижих класа пацијената и да су пацијенти даље лечени Темозоломидом, 6 од 10 пута су рекурентни тумори били агресивнији и добијали алтернативне и више мутација. Како је један од последњих аутора, Цостелло, рекао: "Имали су 20 до 50 пута више мутација. Пацијент који је сам примио операцију и који је можда имао 50 мутација у почетном тумору и 60 у релапсу, пацијенти који су примили ТМЗ могло би имати 2.000 мутација у рецидиву. "[тражи се извор] Надаље, потврђене су нове мутације које носе познате потписе мутација темозоломида. Студија сугерира да тиазоломид треба темељно размотрити за лијечење одређених тумора мозга. Неоправдана употреба Темозоломида може додатно смањити прогнозу или повећати оптерећење пацијента. Даља разумијевања механизма мутације индуковане темозоломидом и нове комбинације могу бити обећавајућа.
Референце
уреди- ^ Мамелак, Адам Н.; Јацобy, Доуглас Б. (1. 3. 2007). „Таргетед деливерy оф антитуморал тхерапy то глиома анд отхер малигнанциес wитх сyнтхетиц цхлоротоxин (ТМ-601)”. Еxперт Опинион он Друг Деливерy. 4 (2): 175—186. ИССН 1742-5247. ПМИД 17335414. дои:10.1517/17425247.4.2.175.
- ^ „Симптоми тумора” (ПДФ). Архивирано из оригинала (ПДФ) 23. 11. 2018. г.
- ^ Раднер, Х.; ел-Схабраwи, Y.; Еибл, Р. Х.; Брüстле, О.; Кеннер, L.; Клеихуес, П.; Wиестлер, О. D. (1993). „Тумор индуцтион бy рас анд мyц онцогенес ин фетал анд неонатал браин: модулатинг еффецтс оф девелопментал стаге анд ретровирал досе”. Ацта Неуропатхологица. 86 (5): 456—465. ИССН 0001-6322. ПМИД 8310796.
- ^ Реусс, Давид; вон Деимлинг, Андреас (2009). „Хередитарy тумор сyндромес анд глиомас”. Рецент Ресултс ин Цанцер Ресеарцх. Фортсцхритте Дер Кребсфорсцхунг. Прогрес Данс Лес Рецхерцхес Сур Ле Цанцер. 171: 83—102. ИССН 0080-0015. ПМИД 19322539. дои:10.1007/978-3-540-31206-2_5.
- ^ „Онкоген” (ПДФ). Архивирано из оригинала (ПДФ) 23. 11. 2018. г.
- ^ „Глиом”. Стетоскоп.инфо (на језику: српски). Архивирано из оригинала 03. 12. 2020. г. Приступљено 26. 7. 2019.
- ^ „Радијација” (ПДФ).
- ^ „Целл Пхонес анд Цанцер Риск Фацт Схеет”. Натионал Цанцер Институте (на језику: енглески). 14. 1. 2019. Приступљено 26. 7. 2019.
- ^ „Медиа Телебриефинг: НТП Целл Пхоне Радиофреqуенцy Радиатион Студy: Партиал Релеасе оф Финдингс”. Натионал Институте оф Енвиронментал Хеалтх Сциенцес (на језику: енглески). Архивирано из оригинала 09. 07. 2019. г. Приступљено 26. 7. 2019.
- ^ ЦНН, Царина Сторрс, фор. „Целл пхоне-релатед цанцер фор ратс раисес аларм”. ЦНН. Приступљено 26. 7. 2019.
- ^ Мицхаелис, Мартин; Баумгартен, Петер; Миттелбронн, Мицхел; Дриевер, Пабло Хернáиз; Доерр, Ханс Wилхелм; Цинатл, Јиндрицх (2011). „Онцомодулатион бy хуман цyтомегаловирус: новел цлиницал финдингс опен неw роадс”. Медицал Мицробиологy анд Иммунологy. 200 (1): 1—5. ИССН 1432-1831. ПМИД 20967552. дои:10.1007/с00430-010-0177-7.
- ^ Дзиурзyнски, Кристине; Цханг, Сусан M.; Хеимбергер, Амy Б.; Калејта, Роберт Ф.; МцГрегор Даллас, Стуарт Р.; Смит, Мартине; Сороцеану, Лилиана; Цоббс, Цхарлес С. (2012). „Цонсенсус он тхе роле оф хуман цyтомегаловирус ин глиобластома”. Неуро-Онцологy. 14 (3): 246—255. ИССН 1522-8517. ПМЦ 3280809 . ПМИД 22319219. дои:10.1093/неуонц/нор227.
- ^ а б Остром, Qуинн Т.; Бауцхет, Луц; Давис, Фаитх Г.; Делтоур, Исабелле; Фисхер, Јамес L.; Лангер, Цхелсеа Еастман; Пекмезци, Мелике; Сцхwартзбаум, Јудитх А.; Турнер, Мицхелле C. (2014). „Тхе епидемиологy оф глиома ин адултс: а “стате оф тхе сциенце” ревиеw”. Неуро-Онцологy. 16 (7): 896—913. ИССН 1522-8517. ПМЦ 4057143 . ПМИД 24842956. дои:10.1093/неуонц/ноу087.
- ^ Цуоззо, Цонцетта; Порцеллини, Антонио; Ангрисано, Тизиана; Морано, Анналиса; Лее, Бонгyонг; Пардо, Алба Ди; Мессина, Самантха; Иулиано, Родолфо; Фусцо, Алфредо (2007). „ДНА Дамаге, Хомологy-Дирецтед Репаир, анд ДНА Метхyлатион”. ПЛоС Генетицс. 3 (7). ИССН 1553-7390. ПМЦ 1913100 . ПМИД 17616978. дои:10.1371/јоурнал.пген.0030110.
- ^ Скириуте, Даина; Ваиткиене, Паулина; Саферис, Викторас; Асмониене, Виргинија; Скауминас, Кестутис; Делтува, Вyтенис Пранас; Тамасаускас, Аримантас (6. 6. 2012). „МГМТ, ГАТА6, ЦД81, ДР4, анд ЦАСП8 гене промотер метхyлатион ин глиобластома”. БМЦ Цанцер. 12: 218. ИССН 1471-2407. ПМЦ 3404983 . ПМИД 22672670. дои:10.1186/1471-2407-12-218.
- ^ „Неуро-Онцологy | Оxфорд Ацадемиц”. Оxфорд Университy Пресс Ацадемиц (на језику: енглески). Приступљено 26. 7. 2019.
- ^ Нараyанан, Латха; Фритзелл, Јамес А.; Бакер, Сеан M.; Лискаy, Р. Мицхаел; Глазер, Петер M. (1. 4. 1997). „Елеватед левелс оф мутатион ин мултипле тиссуес оф мице дефициент ин тхе ДНА мисматцх репаир гене Пмс2”. Процеедингс оф тхе Натионал Ацадемy оф Сциенцес оф тхе Унитед Статес оф Америца. 94 (7): 3122—3127. ИССН 0027-8424. ПМИД 9096356.
- ^ Сеизингер, Бернд Р.; Wиестлер, Отмар D.; Цхунг, Рицхард Y.; Клеихуес, Паул; Петерсен, Ивер; Аммон, Клаус вон; Лоуис, Давид Н.; Охгаки, Хироко; Еибл, Роберт Х. (15. 5. 1992). „п53 Мутатионс Аре Ассоциатед wитх 17п Аллелиц Лосс ин Граде II анд Граде III Астроцyтома”. Цанцер Ресеарцх (на језику: енглески). 52 (10): 2987—2990. ИССН 0008-5472. ПМИД 1349850. Архивирано из оригинала 26. 07. 2019. г. Приступљено 26. 07. 2019.
Спољашње везе
уреди| Класификација |
|---|
- Glioma at the Human Protein Atlas
- American Brain Tumor Association: Malignant Gliomas
- Brain and Spinal Tumors: Hope Through Research (National Institute of Neurological Disorders and Stroke)
- WHO Classification of Glioma
- Glioma Images MedPix Database
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |