Етан
Етан је засићени угљоводоник из хомологог реда алкана са молекулском формулом C2H6. При стандардној температури и притиску, етан је безбојан, безмирисан гас. Етан се у природи јавља као један од састојака земног гаса. Добија се из продуката прераде нафте и каменог угља. Њенова главна примена је као сировина за продукцију етилена.
| |||
| |||
| |||
| Називи | |||
|---|---|---|---|
| Преферисани IUPAC назив
Етан[1] | |||
| Системски IUPAC назив
Дикарбен (није препоручено[1]) | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| Бајлштајн | 1730716 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.741 | ||
| EC број | 200-814-8 | ||
| Гмелин Референца | 212 | ||
| MeSH | Ethane | ||
| RTECS | KH3800000 | ||
| UNII | |||
| UN број | 1035 | ||
| |||
| |||
| Својства | |||
| C2H6 | |||
| Моларна маса | 30,07 g·mol−1 | ||
| Агрегатно стање | Безбојан гас | ||
| Мирис | Без мириса | ||
| Густина |
544,0 kg/m−3 (течност на -88,5 °C) | ||
| Тачка топљења | −182,8 °C; −296,9 °F; 90,4 K | ||
| Тачка кључања | −88,5 °C; −127,4 °F; 184,6 K | ||
| 56,8 mg L−1[5] | |||
| Напон паре | 3,8453 MPa (на 21,1 °C) | ||
| kH | 19 nmol Pa−1 kg−1 | ||
| Киселост (pKa) | 50 | ||
| Базност (pKb) | -36 | ||
| Конјугована киселина | Етанијум | ||
| Магнетна сусцептибилност | -37,37·10−6 cm³/mol | ||
| Термохемија | |||
| Специфични топлотни капацитет, C | 52,49 J K−1 mol−1 | ||
Стандардна енталпија
стварања (ΔfH |
−84 kJ mol−1 | ||
Стд енталпија
сагоревања (ΔcH⦵298) |
−1561,0–−1560,4 kJ mol−1 | ||
| Опасности | |||
| Безбедност приликом руковања | inchem.org | ||
| ГХС пиктограми | 
| ||
| ГХС сигналне речи | Опасност | ||
| H220, H280 | |||
| P210, P410+403 | |||
| NFPA 704 | |||
| Тачка паљења | −135 °C (−211 °F; 138 K) | ||
| 472 °C (882 °F; 745 K) | |||
| Експлозивни лимити | 2.9–13% | ||
| Сродна једињења | |||
Сродна алкани
|
|||
Сродна једињења
|
|||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Сродна једињења могу бити формирана заменом атома водоника са другом функционалном групом; етански део већег молекула се назива етил група. На пример, етилна група повезана са хидроксилном групом даје етанол, алкохол у напицима.
Историја
уредиЕтан је први пут синтетисао 1834 године Мајкл Фарадеј, користећи електролизу раствора калијум ацетата. Он је погрешно сматрао да је угљоводонични производ ове реакције метан и није то даље истраживао.[7] Током периода 1847–1849, у настојању да потврде теорију радикала органске хемије, Херман Колбе и Едвард Франкланд произвели су етан редукцијом пропионитрила (етил цијанида)[8] и етил јодида[9] калијумовим металом, и као Фарадеј, путем електролизе водених ацетата. Међутим, они су погрешно сматрали да је производ реакције метил радикал, а не димер метила, етан. Ову грешку је 1864. године исправио Карл Шорлемер, који је показао да је производ свих ових реакција заправо етан.[10] Етан је октрио растворен у пенсилванијској лакој нафти Едмунд Роналдс 1864. године.[11][12]
Назив етан је изведен из IUPAC номенклатуре органске хемије. „Ет” је изведено из немачке речи за питки алкохол (етанол),[13] а „-ан” указује на присуство једноструке везе између атома угљеника.
Особине
уредиНа стандардној темпрератури и притиску, етан је безбојан, безмирисан гас. Он има тачку кључања од −88,5 °C (−127,3 °F) и тачку топљења од −182,8 °C (−297,0 °F). Чврсти етан постоји у неколико алотропских модификација.[14] При хлађењу под нормалним притиском, прва модификација која се појављује је пластични кристал, који се кристализује у кубном систему. У тој форми, позиције атома водоника нису фиксне; молекули могу слободно да ротирају око дуге осе. Хлађењем етана испод око 89,9 K (−183,2 °C; −297,8 °F) доводи до прелаза у моноклинички метастабилни етан II (просторна група P 21/n).[15] Етан је у веома малој мери растворан у води.
Хемија
уредиЕтан се може посматрати као две спојене метил групе, тј. димер метил група. У лабораторији, етан може бити синтетисан Колбеовом електролизом. У овој техници, водени раствор ацетатне соли се електролизује. На аноди, ацетат се оксидује да би се произвели угљен диоксид и метил радикали, и високо реактивни метил радикали се удружују да би произвели етан:
Синтеза оксидацијом анхидрида сирћетне киселине пероксидима је концептуално слична.
Хемија етана укључује углавном реакције слободних радикала. Етан може да реагује са халогенима, посебно хлором и бромом, путем халогенације слободних радикала. Ова реакција се одвија путем пропагације етил радикала:
Будући да халогенирани етани могу да подлегну даљој халогенацији слободним радикалима, овај процес доводи до мешавине неколико халогенисаних производа. У хемијској индустрији се користе селективније хемијске реакције за формирање било ког халоалкана са два угљеника.
Сагоревање
уредиКомплетним сагоревањем етана ослобађа се 1559,7 kJ/mol, или 51,9 kJ/g, топлоте, и настаје угљен диоксид и вода према хемијској једначини
Сагоревање се исто тако може одвијати без вишка кисеоника, при чему се формира смеша аморфног угљеника и угљен моноксида.
- 2 C2H6 + 3 O2 → 4 C + 6 H2O + енергија
- 2 C2H6 + 5 O2 → 4 CO + 6 H2O + енергија
- 2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + енергија итд.
Сагоревање се одвија путем комплексне серије реакција слободних радикала. Рачунарске симулације хемијске кинетике сагоревања етана обухватају стотине реакција. Једна важна серија реакција у сагоревању етана је комбиновање етил радикала са кисеоником, и накнадни распад резултирајућег пероксида у етокси и хидроксил радикале.
Главни производи који садрже угљеник непотпуног сагоревања етана су једињења угљеника као што су угљен моноксид и формалдехид. Један важан пут којим се угљеник-угљеник веза у етану разлаже, чиме се добијају ти једноугљенични производи, је разградња етокси радикала у метил радикал и формалдехид, који се опет могу подвргнути даљој оксидацији.
- C2H5O• → CH3• + CH2O
Неки од мање заступљених продуката у непотпуном сагоревању етана су ацеталдехид, метан, метанол, и етанол. На вишим температурама, а посебно у опсегу 600—900 °C (1.112—1.652 °F), етилен је значајан придукат. Он настаје путем реакција као што је ова:
Сличне реакције (са другим агенсим, осим кисеоника, као водонични апстрактор) се одвијају у продукцији етилена из етана у парном крековању.
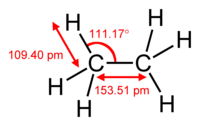
Етанска баријера
уредиРотација молекуларне подструктуре око ротирајуће везе обично захтева енергију. Минимална енергија за производњу ротације од 360 степени назива се ротациона баријера.
Етан пружа класичан, једноставан пример такве ротационе баријере, која се понекад назива „етанском баријером”. Међу најранијим експерименталним доказима ове баријере (погледајте дијаграм лево) су они добијени моделовањем ентропије етана.[17] Три водоника на сваком крају су слободна да се врте око централне везе угљеник-угљеник када им се обезбеди довољна енергија за превазилажење баријере. Физичко порекло баријере још увек није потпуно решено,[18] иако је преклапање (размена) одбијања[19] између атома водоника на супротним крајевима молекула можда најјачи кандидат, са стабилизирајућим ефектом хиперкоњугације на распоређеној конформацији која доприноси феномену.[20] Теоријске методе које користе одговарајућу полазну тачку (ортогоналне орбитале) потврђују да је хиперкоњугација најважнији фактор у настанку баријере ротације етана.[21][22]
Још су током периода 1890-1891 хемичари предложили да молекули етана преферирају распоређену конформацију са крајевима молекула удаљеним једани од других.[23][24][25][26]
Продукција
уредиПосле метана, етан је друга по величини компонента природног гаса. Природни гас из различитих гасних поља варира у садржају етана од мање од 1% до више од 6% по запремини. Пре 1960-их, етан и већи молекули обично нису били одвајани од метанске компоненте природног гаса, већ су једноставно сагоревани заједно с метаном као горивом. Данас је етан важна петрохемијска сировина и одваја се од осталих компоненти природног гаса у већини добро развијених гасних поља. Етан се такође може одвојити из нафтног гаса, мешавине гасовитих угљоводоника који се производе као нуспроизвод прераде нафте. Међутим, економија изградње и операције погона за прераду може да буде промењена. Ако релативна вредност слања непрерађеног природног гаса потрошачу превазилази вредност екстракције етана, могуће је да се екстракција етана не врши, што може да доведе до оперативних проблема при примени гаса измењеног квалитета у низводним системима.
Етан се најефикасније одваја од метана утечњавањем на криогенским температурама. Постоје различите стратегије хлађења: најекономичнији процес који се тренутно користи у широкој употреби користи турбоекспандер, и може повратити више од 90% етана у природном гасу. У овом процесу, охлађени гас се експандира кроз турбину, смањујући температуру на око −100 °C (−148 °F). На овој ниској температури, гасовити метан се може издвојити из течног етана и тежих угљоводоника дестилацијом. Даљом дестилацијом се затим раздваја етан од пропана и тежих угљоводоника.
Лабораторијски се добија електролизом концентрованог раствора ацетата:
Референце
уреди- ^ а б Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 4. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001. „Similarly, the retained names ‘ethane’, ‘propane’, and ‘butane’ were never replaced by systematic names ‘dicarbane’, ‘tricarbane’, and ‘tetracarbane’ as recommended for analogues of silane, ‘disilane’; phosphane, ‘triphosphane’; and sulfane, ‘tetrasulfane’.”
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „Ethane – Compound Summary”. PubChem Compound. USA: National Center for Biotechnology Information. 16. 9. 2004. Приступљено 7. 12. 2011.
- ^ Lide, D. R., ур. (2005). CRC Handbook of Chemistry and Physics (86th изд.). Boca Raton (FL): CRC Press. стр. 8.88. ISBN 0-8493-0486-5.
- ^ „Le coq”. elysee.fr (на језику: француски). 16. 11. 2012. Приступљено 29. 8. 2023.
|first1=захтева|last1=у Authors list (помоћ) - ^ Faraday, Michael (1834). „Experimental researches in electricity: Seventh series”. Philosophical Transactions. 124: 77—122. doi:10.1098/rstl.1834.0008.
- ^ Kolbe, Hermann; Frankland, Edward (1849). „On the products of the action of potassium on cyanide of ethyl”. Journal of the Chemical Society. 1: 60—74. doi:10.1039/QJ8490100060.
- ^ Frankland, Edward (1850). „On the isolation of the organic radicals”. Journal of the Chemical Society. 2 (3): 263—296. doi:10.1039/QJ8500200263.
- ^ Schorlemmer, Carl (1864). „Ueber die Identität des Aethylwasserstoffs und des Methyls”. Annalen der Chemie und Pharmacie. 132 (2): 234. doi:10.1002/jlac.18641320217.
- ^ Roscoe, H.E.; Schorlemmer, C. (1881). Treatise on Chemistry. 3. Macmillan. стр. 144—145.
- ^ Watts, H. (1868). Dictionary of Chemistry. 4. стр. 385.
- ^ „the definition of ethyl”. Dictionary.com. Приступљено 12. 3. 2016.
- ^ Van Nes, G.J.H.; Vos, A. (1978). „Single-crystal structures and electron density distributions of ethane, ethylene and acetylene. I. Single-crystal X-ray structure determinations of two modifications of ethane” (PDF). Acta Crystallographica Section B. 34 (6): 1947. doi:10.1107/S0567740878007037.
- ^ „Ethane as a solid”. Paarpraxis-rheinmain.de. Архивирано из оригинала 10. 5. 2017. г. Приступљено 16. 12. 2016.
- ^ J, McMurry (2012). Organic chemistry (8 изд.). Belmont, CA: Brooks. стр. 95. ISBN 9780840054449.
- ^ Kemp, J. D.; Pitzer, Kenneth S. (1937). „The Entropy of Ethane and the Third Law of Thermodynamics. Hindered Rotation of Methyl Groups”. Journal of the American Chemical Society. 59 (2): 276. doi:10.1021/ja01281a014.
- ^ Ercolani, G. (2005). „Determination of the Rotational Barrier in Ethane by Vibrational Spectroscopy and Statistical Thermodynamics”. J. Chem. Educ. 82 (11): 1703—1708. Bibcode:2005JChEd..82.1703E. doi:10.1021/ed082p1703.
- ^ Pitzer, R.M. (1983). „The Barrier to Internal Rotation in Ethane”. Acc. Chem. Res. 16 (6): 207—210. doi:10.1021/ar00090a004.
- ^ Mo, Y.; Wu, W.; Song, L.; Lin, M.; Zhang, Q.; Gao, J. (2004). „The Magnitude of Hyperconjugation in Ethane: A Perspective from Ab Initio Valence Bond Theory”. Angew. Chem. Int. Ed. 43 (15): 1986—1990. doi:10.1002/anie.200352931.
- ^ Pophristic, V.; Goodman, L. (2001). „Hyperconjugation not steric repulsion leads to the staggered structure of ethane”. Nature. 411 (6837): 565—8. PMID 11385566. doi:10.1038/35079036.
- ^ Schreiner, P. R. (2002). „Teaching the right reasons: Lessons from the mistaken origin of the rotational barrier in ethane”. Angewandte Chemie International Edition. 41 (19): 3579—81, 3513. PMID 12370897. doi:10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S.
- ^ Bischoff, CA (1890). „Ueber die Aufhebung der freien Drehbarkeit von einfach verbundenen Kohlenstoffatomen”. Chem. Ber. 23: 623. doi:10.1002/cber.18900230197.
- ^ Bischoff, CA (1891). „Theoretische Ergebnisse der Studien in der Bernsteinsäuregruppe”. Chem. Ber. 24: 1074. doi:10.1002/cber.189102401195.
- ^ Bischoff, CA (1891). „Die dynamische Hypothese in ihrer Anwendung auf die Bernsteinsäuregruppe”. Chem. Ber. 24: 1085. doi:10.1002/cber.189102401196.
- ^ Bischoff, C.A.; Walden, P. (1893). „Die Anwendung der dynamischen Hypothese auf Ketonsäurederivate”. Berichte der deutschen chemischen Gesellschaft. 26 (2): 1452. doi:10.1002/cber.18930260254.