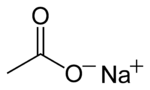
Natrijum acetat
Natrijum acetat je bezbojna so natrijuma sa sirćetnom kiselinom. Dobija se putem reakcije natrijum hidroksida, natrijum karbonata ili natrijum hidrogen karbonata sa sirćetnom kiselinom. Ova so ima slab sirćetni miris.[3]
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Natrijum acetat
| |||
| Sistemski IUPAC naziv
Natrijum etanolat | |||
| Identifikacija | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.386 | ||
| E-brojevi | E262 (konzervansi) | ||
| RTECS | AJ4300010 (anhidrat) AJ4580000 | ||
| Svojstva | |||
| C2H3NaO2 | |||
| Molarna masa | 82,0338 g/mol (anhidrat) 136,08 g/mol (trihidrat) | ||
| Agregatno stanje | beo prah | ||
| Gustina | 1,528 g/cm3 1.45 g/cm3 (trihidrat) | ||
| Tačka topljenja | 324°C (anhidrat) 58°C (trihidrat) | ||
| Tačka ključanja | 881.4°C (anhidrat) 122°C (trihidrat) | ||
| 36.2 g/100 ml (0°C) 46.4 g/100 mL (20°C) 139 g/100 mL (60°C) 170.15 g/100 mL (100°C) | |||
| Rastvorljivost | rastvorna u etanolu (5.3 g/100 mL (trihidrat) | ||
| Baznost (pKb) | 9.25 | ||
| Indeks refrakcije (nD) | 1.464 | ||
| Struktura | |||
| Kristalna rešetka/struktura | monoklonalna | ||
| Opasnosti | |||
| Opasnost u toku rada | Iritant | ||
| Bezbednost prilikom rukovanja | Spoljašnji MSDS | ||
| NFPA 704 | |||
| Tačka paljenja | 250°C | ||
| 607 °C (1.125 °F; 880 K) | |||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||

Osobine
уредиIz vodenog rastvora natrijum acetat kristalizira sa 3 mola kristalne vode: Na(CH3COO) • 3 H2O. Ovaj trihidrat formira velike bezbojne kristale.[4] Dobro je rastvorljiv u vodi (612 g/l pri 20 °C). Raspada se na 58 °C. Na višim temperaturama isparava kristalna voda, te nastaje bezvodni natrijum acetat Na(CH3COO). Ova bezvodna so je takođe bezbojna. Ona je veoma higroskopna, te lako vezuje vlagu iz vazduha. Nešto slabije je rastvorljiva u vodi (365 g/l pri 20 °C).[5] Smješa natrijum acetata i sirćetne kiseline se koristi kao pufer, što znači da njena pH vrednost ostaje gotovo ista nakon dodavanja (manjih količina) baza ili kiselina.[6] Natrijum acetat se slabo rastvara u alkoholima.
Upotreba
уредиNatrijum acetat kao dodatak hrani nosi oznaku E262. Koristi se kao regulator kiselina, i kao sredstvo za konzerviranje voća i povrća, zatim za konzerviranje peciva, ribe, salate, majoneza i drugih namirnica.
Vidi još
уредиReference
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Рајковић, М. Б.; et al. (1993). Аналитичка хемија. Београд: Савремена администрација.
- ^ Thomas L. Lemke; David A. Williams, ур. (2002). „Chapter 2. Drug design and relationship of functional groups to pharmacologic activity; Physicochemical properties of drugs acid/base properties”. Foye's Principles of Medicinal Chemistry (5. изд.). Baltimore: Lippincott Willams & Wilkins. ISBN 0781744431.


