Propionska kiselina
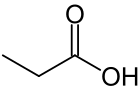
Propionska kiselina (propanska kiseline) je karboksilna kiselina koja se javlja u prirodi. Njena hemijska formula je CH3CH2COOH. Ona je čista tečnost oporog mirisa. Anjon CH3CH2COO−, kao i soli i estri propiponske kiseline su poznati kao propionati (ili propanati).[3][4]
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
propanoinska kiselina
| |||
| Drugi nazivi
etankarboksilna kiselina
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.001.070 | ||
| E-brojevi | E280 (konzervansi) | ||
| RTECS | UE5950000 | ||
| |||
| Svojstva | |||
| C3H6O2 | |||
| Molarna masa | 74,08 g·mol−1 | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 0,99 g/cm3 | ||
| Tačka topljenja | −21 °C (−6 °F; 252 K) | ||
| Tačka ključanja | 141 °C (286 °F; 414 K) | ||
| meša se | |||
| Kiselost (pKa) | 4.87 | ||
| Viskoznost | 10 mPa·s | ||
| Struktura | |||
| Dipolni moment | 0.63 D | ||
| Opasnosti | |||
| Opasnost u toku rada | Korozivna je | ||
| Bezbednost prilikom rukovanja | External MSDS | ||
| R-oznake | R34 | ||
| S-oznake | (S1/2) S23 S36 S45 | ||
| NFPA 704 | |||
| Tačka paljenja | 327 K, 54°C | ||
| Srodna jedinjenja | |||
Drugi anjoni
|
Propionat | ||
Srodne karboksilne kiseline
|
Sirćetna kiselina Mlečna kiselina 3-hidroksipropionska kiselina Tartronska kiselina Akrilna kiselina Buterna kiselina | ||
Srodna jedinjenja
|
1-propanol Propionaldehid Natrijum propionat Propionski anhidrid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Osobine
уредиPropionska kiselina ima fizičke osobine koje su između osobina malih karboksilnih kiselina, mravlje i sirćetne kiseline, i većih masnih kiselina. Ona se meša sa vodom, ali se može odvojiti dodatkom soli. Kao i sirćetna i mravlja kiselina, ona se sastoji od vodonično vezanih parova molekula u tečnom stanju i pari.
Propionska kiselina manifestuje opšta svojstva karboksilnih kiselina: ona može da formira amide, estre, kisele anhidride, i hloridne derivate. On može da podlegne alfa-halogenaciji sa bromom u prisustvu PBr3 katalizatora (HVZ reakcija) da formira CH3CHBrCOOH.[5]
Reference
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ C. S. Marvel; V. du Vigneaud (1931). „α-bromo-Isovaleric acid”. Org. Synth. 11: 20.; Coll. Vol., 2, стр. 93