Пропионска киселина
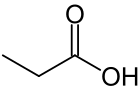
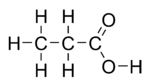
Пропионска киселина (пропанска киселине) је карбоксилна киселина која се јавља у природи. Њена хемијска формула је CH3CH2CОOH. Она је чиста течност опорог мириса. Ањон CH3CH2COO−, као и соли и естри пропипонске киселине су познати као пропионати (или пропанати).[3][4]
| |||
| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
propanoinska kiselina
| |||
| Други називи
етанкарбоксилна киселина
| |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.001.070 | ||
| Е-бројеви | Е280 (конзерванси) | ||
| RTECS | УЕ5950000 | ||
| |||
| Својства | |||
| C3H6O2 | |||
| Моларна маса | 74,08 g·mol−1 | ||
| Агрегатно стање | безбојна течност | ||
| Густина | 0,99 g/cm3 | ||
| Тачка топљења | −21 °C (−6 °F; 252 K) | ||
| Тачка кључања | 141 °C (286 °F; 414 K) | ||
| меша се | |||
| Киселост (пКа) | 4.87 | ||
| Вискозност | 10 mPa·s | ||
| Структура | |||
| Диполни момент | 0.63 D | ||
| Опасности | |||
| Опасност у току рада | Корозивна је | ||
| Безбедност приликом руковања | External MSDS | ||
| R-oznake | R34 | ||
| S-oznake | (S1/2) S23 S36 S45 | ||
| NFPA 704 | |||
| Tačka paljenja | 327 K, 54°C | ||
| Сродна једињења | |||
Други ањони
|
Пропионат | ||
Сродне карбоксилне киселине
|
Сирћетна киселина Млечна киселина 3-хидроксипропионска киселина Тартронска киселина Акрилна киселина Бутерна киселина | ||
Сродна једињења
|
1-пропанол Пропионалдехид Натријум пропионат Пропионски анхидрид | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Особине
уредиПропионска киселина има физичке особине које су између особина малих карбоксилних киселина, мравље и сирћетне киселине, и већих масних киселина. Она се меша са водом, али се може одвојити додатком соли. Као и сирћетна и мравља киселина, она се састоји од водонично везаних парова молекула у течном стању и пари.
Пропионска киселина манифестује општа својства карбоксилних киселина: она може да формира амиде, естре, киселе анхидриде, и хлоридне деривате. Он може да подлегне алфа-халогенацији са бромом у присуству PBr3 катализатора (ХВЗ реакција) да формира CH3CHBrCOOH.[5]
Референце
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- ^ МцМуррy Јохн Е. (1992). Фундаменталс оф Органиц Цхемистрy (3рд изд.). Белмонт: Wадсwортх. ISBN 0-534-16218-5.
- ^ C. С. Марвел; V. ду Вигнеауд (1931). „α-бромо-Исовалериц ацид”. Орг. Сyнтх. 11: 20.; Цолл. Вол., 2, стр. 93