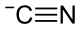Natrijum cijanid
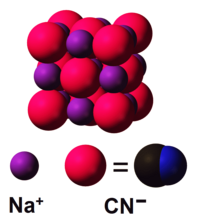
Natrijum cijanid je natrijumova so cijanovodonične kiseline. Ovo jedinjenje ima hemijsku formulu NaCN. Na sobnoj temperaturi ova so je bezbojan kristalni prah, koji ima slab miris na gorke bademe. Veoma je higroskopana.
|
| |||
| |||
| Identifikacija | |||
|---|---|---|---|
| ECHA InfoCard | 100.005.091 | ||
| RTECS | VZ7525000 | ||
| UN broj | 1689 | ||
| Svojstva | |||
| NaCN | |||
| Molarna masa | 49,0072 g/mol | ||
| Agregatno stanje | beli prah | ||
| Gustina | 1,595 g/cm³[3] | ||
| Tačka topljenja | 563.7 °C | ||
| Tačka ključanja | 1496 °C | ||
| 58 g/100 ml (20 °C) (rastvorljivost hidrata), 82 g/100 ml (34.7 °C) | |||
| Indeks refrakcije (nD) | 1.45 | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | ICSC 1118 | ||
EU klasifikacija (DSD)
|
veoma toksičan (T+) Opasan za okruženje (N) Korozivan (C)[4] | ||
| R-oznake | R26/27/28, R32, R50/53 | ||
| S-oznake | (S1/2), S7, S28, S29, S45, S60, S61 | ||
| NFPA 704 | |||
| Tačka paljenja | ne-zapaljiv | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LD50 (LD50)
|
5.8–15 mg/kg (oralno kod pacova, miševa)[5] | ||
| Srodna jedinjenja | |||
Drugi katjoni
|
kalijum cijanid | ||
Srodna jedinjenja
|
cijanovodonična kiselina | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Dobijanje
уредиNatrijum cijanid se dobija procesom neutralizacije cijanovodonične kiseline i natrijum hidroksida (sode) putem Andrusove reakcije. Za sintezu natrijum cijanida se koriste metan, amonijak i kiseonik.
- Metan, amonijak i kiseonik reaguju na temperaturi od 1546 °C te uz prisustvo platine kao katalizatora dobija se voda i cijanovodonična kiselina.
Slijedi reakcija neutralizacije cijanovodonične kiseline i sode.
- Cijanovodonična kiselina i soda daju natrijum cijanid i vodu.
Ranije se natrijum cijanid dobijao putem reakcije natrijuma sa ugljom i amonijakom.
Upotreba
уредиNatrijum cijanid zajedno sa kalijum cijanidom se upotrebljava u proizvodnji plemenitih metala zlata i srebra. U galvanskoj tehnici se koristi u raznim cijanidnim kadama, npr. u cijanidnim kadama za bakar, mesing, bronzu, cink, kadmijum i zlato.
U organskoj hemiji natrijum cijanid se koristi u raznim sintezama. Natrijum cijanid je otrovan za ljude. Smrtonosna doza (oralno) iznosi oko 2,8 mg po kilogramu tjelesne mase.[6]
Reference
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ GESTIS baza podataka[мртва веза]
- ^ Oxford MSDS
- ^ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. стр. 361. ISBN 978-1-903996-65-2.
- ^ assets.chemportals.merck.de[мртва веза]