Ожеов ефекат
Ожеов ефекат (Ожеов електрон) је емисија секундарног електрона из атомског омотача[1] проузрокована емисијом електрона (стимулисаном спољашњим агенсом) из стања са великом везивном енергијом.[2] Овај секундарни електрон, који излеће из слабије везаног стања, назива се Ожеов електрон. На његово место углавном долази сусједни електрон са већом везивном енергијом, који тај вишак енергије емитује као фотон - у пракси је познат као карактеристични фотон (јер има познату енергију).[3] На тај начин је могуће добити и рендгенске зраке или гама зрачење..
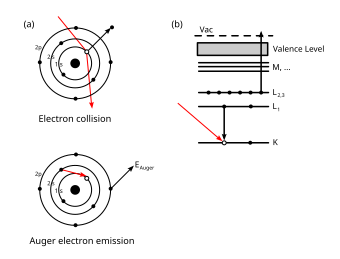
Ефекат и секундарни електрон име су добили по француском физичару Пјеру Ожеу (фр. Pierre Victor Auger) који је појаву описао.
Ефекат
уредиЕфекат је први пут открила Лиза Мајтнер 1922. године; Пјер Виктор Оже је независно открио ефекат убрзо након тога и придају му се заслуге за откриће од стране већине научне заједнице.[4][5]
При избацивању, кинетичка енергија Ожеовог електрона одговара разлици између енергије почетног електронског прелаза[6] у празнину и енергије јонизације[7] за електронски омотач из којег је Ожеов електрон избачен. Ови нивои енергије зависе од врсте атома и хемијске средине у којој се атом налазио.
Ожеова електронска спектроскопија укључује емисију Ожеових електрона бомбардовањем узорка било рендгенским зрацима или енергетским електронима и мери интензитет Ожеових електрона који настају као функција енергије Ожеових електрона. Добијени спектри се могу користити за одређивање идентитета емитујућих атома и неких информација о њиховом окружењу.
Ожеова рекомбинација је слична Ожеовом ефекту али се јавља у полупроводницима. Електрон и електронска рупа (пар електрон-рупа) могу рекомбиновати дајући своју енергију електрону у проводном појасу, повећавајући његову енергију. Обрнути ефекат је познат као ударна јонизација.
Ожеов ефекат може утицати на биолошке молекуле као што је ДНК. Након јонизације К-љуске компонентних атома ДНК, Ожерови електрони се избацују што доводи до оштећења његове шећерно-фосфатне кичме.[8]
Историја
уредиОвај процес емисије електрона теоријски је предвидео Роселанд 1923.[9] а прва је открила Лиза Мајтнер (нем. Lise Meitner) 1920. године и објавила 1922/3.[10][11] Касније је процес открио и Оже, објавио 1925. године и дао му своје име.[12]
Француски физичар Пјер Виктор Оже га је независно открио 1923. године[13] након анализе експеримента Вилсонове маглене коморе и постао је централни део његовог докторског рада.[14] Рендгенски зраци високе енергије су примењени да би се јонизовале честице гаса и посматрали фотоелектрични електрони. Посматрање електронских трагова који су били независни од фреквенције упадног фотона сугерисали су механизам за јонизацију електрона који је био узрокован унутрашњом конверзијом енергије из транзиције без зрачења. Даља истраживања и теоријски рад користећи елементарну квантну механику и прорачуне брзине прелаза/вероватноће прелаза, показали су да се ради о безрадијационом ефекту, пре него ефекту унутрашње конверзије.[15]
Види још
уредиРеференце
уреди- ^ Rassolov, Vitaly A; Pople, John A; Redfern, Paul C; Curtiss, Larry A (2001-12-28). „The definition of core electrons”. Chemical Physics Letters. 350 (5–6): 573—576. Bibcode:2001CPL...350..573R. doi:10.1016/S0009-2614(01)01345-8.
- ^ IUPAC. „Auger effect”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ IUPAC. „Auger electron”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Grant, John T.; David Briggs (2003). Surface Analysis by Auger and X-ray Photoelectron Spectroscopy. Chichester: IM Publications. ISBN 1-901019-04-7.
- ^ Matsakis, Demetrios; Coster, Anthea; Laster, Brenda; Sime, Ruth (2019-09-01). „A renaming proposal: "The Auger–Meitner effect"”. Physics Today. 72 (9): 10—11. Bibcode:2019PhT....72i..10M. ISSN 0031-9228. S2CID 202939712. doi:10.1063/PT.3.4281.
- ^ Deléglise, S. „Observing the quantum jumps of light” (PDF). Архивирано из оригинала (PDF) 7. 11. 2010. г. Приступљено 17. 9. 2010.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey (1988). Advanced Inorganic Chemistry (5th изд.). John Wiley. стр. 1381. ISBN 0-471-84997-9.
- ^ Akinari Yokoya & Takashi Ito (2017) Photon-induced Auger effect in biological systems: a review,International Journal of Radiation Biology, 93:8, 743–756, . doi:10.1080/09553002.2017.1312670. Недостаје или је празан параметар
|title=(помоћ) - ^ S. Rosseland, Zeitschrift für Physik 14, 173 (1923).}-
- ^ L. Meitner (1922). „Über die Entstehung der β-Strahl-Spektren radioaktiver Substanzen”. Z. Phys. 9 (1): 131—144. Bibcode:1922ZPhy....9..131M. S2CID 121637546. doi:10.1007/BF01326962.
- ^ L. Meitner, Zeitschrift für Physik 17, 54 (1923).
- ^ -{P. Auger, Journal de Physique Radium 6, 205 (1925).
- ^ P. Auger: Sur les rayons β secondaires produits dans un gaz par des rayons X, C.R.A.S. 177 (1923) 169–171.
- ^ Duparc, Olivier Hardouin (2009). „Pierre Auger – Lise Meitner: Comparative contributions to the Auger effect”. International Journal of Materials Research. 100 (9): 1162—1166. S2CID 229164774. doi:10.3139/146.110163.
- ^ „The Auger Effect and Other Radiationless Transitions”. Cambridge University Press. Приступљено 2015-12-11.
Литература
уреди- С. Мацура; Ј. Радић-Перић (2004). Атомистика. Београд: Факултет за физичку хемију Универзитета у Београду/Службени лист. стр. 263.
- Miessler, Tarr, G.L. (1999). Inorganic Chemistry. Prentice-Hall.
- „Quantum Primer”. www.chem1.com. Приступљено 2015-12-11.
- „Periodic Trends”. Chemistry LibreTexts (на језику: енглески). 2013-10-02. Приступљено 2020-09-13.
- Miessler, Gary L.; Tarr, Donald A. (1999). Inorganic Chemistry (2nd изд.). Prentice Hall. стр. 41. ISBN 0-13-841891-8.
- „Ionization Energy”. ChemWiki. University of California, Davis. 2013-10-02. Архивирано из оригинала 30. 04. 2010. г. Приступљено 10. 07. 2022.
- „Chapter 9: Quantum Mechanics”. faculty.chem.queesu.ca (на језику: енглески). 15. 1. 2018. Архивирано из оригинала 24. 07. 2020. г. Приступљено 31. 10. 2020.
- Stone, E.G. (19. 12. 2020v). „Atomic Structure : Periodic Trends”. Department of Chemistry. chem.tamu.edu (на језику: енглески). 400 Bizzell St, College Station, TX 77843, Texas, United States: Texas A&M University. Архивирано из оригинала 11. 10. 2018. г. Приступљено 19. 12. 2020.
- „Anomalous trends in ionization energy”. Chemistry Stack Exchange. Приступљено 2020-09-20.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th изд.). Prentice Hall. стр. 370. ISBN 0-13-014329-4.
- Grandinetti, Philip J. (8. 9. 2019). „Ionization Energy Trends | Grandinetti Group”. www.grandinetti.org. Приступљено 2020-09-13.
- Kent, Mr. „First Ionization Energy”. kentchemistry.com. KentChemistry. Приступљено 6. 12. 2020. „...The addition of the second electron into an already occupied orbital introduces repulsion between the electrons, thus it is easier to remove. that is why there is a dip in the ionization energy.”
- „Group IA”. chemed.chem.purdue.edu. Приступљено 2020-09-20.
- „Alkali Metals”. hyperphysics.phy-astr.gsu.edu. Приступљено 2020-09-13.
- „The Alkali Metals | Introduction to Chemistry”. courses.lumenlearning.com. Приступљено 2020-09-13.
- „Chemical elements listed by ionization energy”. lenntech.com. Lenntech BV. 2018. Приступљено 6. 12. 2020. „The elements of the periodic table sorted by ionization energy click on any element's name for further information on chemical properties, environmental data or health effects. This list contains the 118 elements of chemistry.”
- Boudreaux, K.A. (13. 8. 2020). „The Parts of the Periodic Table”. Department of Chemistry and Biochemistry. angelo.edu/faculty/kboudrea/ (на језику: енглески). 2601 W. Avenue N, San Angelo, TX 76909, Texas: Angelo State University. Архивирано из оригинала 10. 07. 2022. г. Приступљено 19. 12. 2020 — преко angelo.edu.
- „18.10: The Group 6A Elements”. Chemistry LibreTexts (на језику: енглески). 2014-07-02. Приступљено 2020-09-20.
- „Covalent Radius for all the elements in the Periodic Table”. periodictable.com. Приступљено 2020-09-13.
- Sikander (5. 12. 2015). „Why is ionisation energy of bismuth lower than lead?”. chemistry.stackexchange.com. Chemistry Stack Exchange. Приступљено 5. 12. 2020. „Why is ionisation enthalpy of Bismuth less than that of Lead for it just comes after the latter in periodic table?”
- Ball, Philip (21. 4. 2017). „The group 3 dilemma”. chemistryworld.com (на језику: енглески). Burlington House, Piccadilly, London: Chemistry World. Приступљено 18. 12. 2020 — преко Royal Society of Chemistry.
- Yirka, Bob (9. 4. 2015). „Measurement of first ionization potential of lawrencium reignites debate over periodic table”. General Physics. phys.org (на језику: енглески). Phys Org. Phys.org. Приступљено 13. 12. 2020. „Lawrencium, at this time, appears to have a dumb-bell shape. These new findings create conflicting views on where the element should be placed on the table and has reignited debate on the way the table is structured in general.”
- Scerri, Eric R.; Parsons, William (март 2017). „What elements belong in group 3 of the periodic table?”. www.ionicviper.org. Ionic Viper. Приступљено 7. 12. 2020. „The question of precisely which elements should be placed in group 3 of the periodic table has been debated from time to time with apparently no resolution up to this point.”
- Sato, T. K.; Asai, M.; Borschevsky, A.; Stora, T.; Sato, N.; Kaneya, Y.; Tsukada, K.; Düllmann, Ch E.; Eberhardt, K.; Eliav, E.; Ichikawa, S.; Kaldor, U.; Kratz, J. V.; Miyashita, S.; Nagame, Y.; Ooe, K.; Osa, A.; Renisch, D.; Runke, J.; Schädel, M.; Thörle-Pospiech, P.; Toyoshima, A.; Trautmann, N. (април 2015). „Measurement of the first ionization potential of lawrencium, element 103”. Nature. 520 (7546): 209—211. Bibcode:2015Natur.520..209S. PMID 25855457. S2CID 4384213. doi:10.1038/nature14342.
- Singh, Jasvinder (1999). „Inert Gases”. Sterling Dictionary of Physics. Sterling Publishers Pvt. Ltd. стр. 122. ISBN 978-81-7359-124-2.
- „Vanadium, Niobium and Tantalum”. Chemistry of the Elements. 1997. стр. 976—1001. ISBN 978-0-7506-3365-9. doi:10.1016/B978-0-7506-3365-9.50028-6.
- Housecroft, C.E.; Sharpe, A.G. (1. 11. 1993). Inorganic Chemistry (eBook). Inorganic Chemistry (на језику: енглески). 3 (15th изд.). Switzerland: Pearson Prentice-Hall. стр. 536, 649, 743. ISBN 978-0-273-74275-3. doi:10.1021/ed070pA304.1. Архивирано из оригинала 10. 07. 2022. г. Приступљено 14. 12. 2020.
- Billo, E. J. (1985). „Modern Inorganic Chemistry (Jolly, William L.)”. Journal of Chemical Education. 62 (4): A137. Bibcode:1985JChEd..62..137B. doi:10.1021/ed062pA137.1 .
Спољашње везе
уреди- Mahan, Bruce H. (1962). „Ionization Energy”. College of Chemistry, University of California Berkeley. Приступљено 2020-09-13.
- „Monatomic Gas - an overview | ScienceDirect Topics”. www.sciencedirect.com. Приступљено 2022-01-08.