Ožeov efekat
Ožeov efekat (Ožeov elektron) je emisija sekundarnog elektrona iz atomskog omotača[1] prouzrokovana emisijom elektrona (stimulisanom spoljašnjim agensom) iz stanja sa velikom vezivnom energijom.[2] Ovaj sekundarni elektron, koji izleće iz slabije vezanog stanja, naziva se Ožeov elektron. Na njegovo mesto uglavnom dolazi susjedni elektron sa većom vezivnom energijom, koji taj višak energije emituje kao foton - u praksi je poznat kao karakteristični foton (jer ima poznatu energiju).[3] Na taj način je moguće dobiti i rendgenske zrake ili gama zračenje..
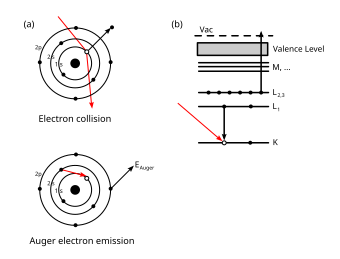
Efekat i sekundarni elektron ime su dobili po francuskom fizičaru Pjeru Ožeu (fr. Pierre Victor Auger) koji je pojavu opisao.
Efekat
urediEfekat je prvi put otkrila Liza Majtner 1922. godine; Pjer Viktor Ože je nezavisno otkrio efekat ubrzo nakon toga i pridaju mu se zasluge za otkriće od strane većine naučne zajednice.[4][5]
Pri izbacivanju, kinetička energija Ožeovog elektrona odgovara razlici između energije početnog elektronskog prelaza[6] u prazninu i energije jonizacije[7] za elektronski omotač iz kojeg je Ožeov elektron izbačen. Ovi nivoi energije zavise od vrste atoma i hemijske sredine u kojoj se atom nalazio.
Ožeova elektronska spektroskopija uključuje emisiju Ožeovih elektrona bombardovanjem uzorka bilo rendgenskim zracima ili energetskim elektronima i meri intenzitet Ožeovih elektrona koji nastaju kao funkcija energije Ožeovih elektrona. Dobijeni spektri se mogu koristiti za određivanje identiteta emitujućih atoma i nekih informacija o njihovom okruženju.
Ožeova rekombinacija je slična Ožeovom efektu ali se javlja u poluprovodnicima. Elektron i elektronska rupa (par elektron-rupa) mogu rekombinovati dajući svoju energiju elektronu u provodnom pojasu, povećavajući njegovu energiju. Obrnuti efekat je poznat kao udarna jonizacija.
Ožeov efekat može uticati na biološke molekule kao što je DNK. Nakon jonizacije K-ljuske komponentnih atoma DNK, Ožerovi elektroni se izbacuju što dovodi do oštećenja njegove šećerno-fosfatne kičme.[8]
Istorija
urediOvaj proces emisije elektrona teorijski je predvideo Roseland 1923.[9] a prva je otkrila Liza Majtner (nem. Lise Meitner) 1920. godine i objavila 1922/3.[10][11] Kasnije je proces otkrio i Ože, objavio 1925. godine i dao mu svoje ime.[12]
Francuski fizičar Pjer Viktor Ože ga je nezavisno otkrio 1923. godine[13] nakon analize eksperimenta Vilsonove maglene komore i postao je centralni deo njegovog doktorskog rada.[14] Rendgenski zraci visoke energije su primenjeni da bi se jonizovale čestice gasa i posmatrali fotoelektrični elektroni. Posmatranje elektronskih tragova koji su bili nezavisni od frekvencije upadnog fotona sugerisali su mehanizam za jonizaciju elektrona koji je bio uzrokovan unutrašnjom konverzijom energije iz tranzicije bez zračenja. Dalja istraživanja i teorijski rad koristeći elementarnu kvantnu mehaniku i proračune brzine prelaza/verovatnoće prelaza, pokazali su da se radi o bezradijacionom efektu, pre nego efektu unutrašnje konverzije.[15]
Vidi još
urediReference
uredi- ^ Rassolov, Vitaly A; Pople, John A; Redfern, Paul C; Curtiss, Larry A (2001-12-28). „The definition of core electrons”. Chemical Physics Letters. 350 (5–6): 573—576. Bibcode:2001CPL...350..573R. doi:10.1016/S0009-2614(01)01345-8.
- ^ IUPAC. „Auger effect”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ IUPAC. „Auger electron”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Grant, John T.; David Briggs (2003). Surface Analysis by Auger and X-ray Photoelectron Spectroscopy. Chichester: IM Publications. ISBN 1-901019-04-7.
- ^ Matsakis, Demetrios; Coster, Anthea; Laster, Brenda; Sime, Ruth (2019-09-01). „A renaming proposal: "The Auger–Meitner effect"”. Physics Today. 72 (9): 10—11. Bibcode:2019PhT....72i..10M. ISSN 0031-9228. S2CID 202939712. doi:10.1063/PT.3.4281.
- ^ Deléglise, S. „Observing the quantum jumps of light” (PDF). Arhivirano iz originala (PDF) 7. 11. 2010. g. Pristupljeno 17. 9. 2010.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey (1988). Advanced Inorganic Chemistry (5th izd.). John Wiley. str. 1381. ISBN 0-471-84997-9.
- ^ Akinari Yokoya & Takashi Ito (2017) Photon-induced Auger effect in biological systems: a review,International Journal of Radiation Biology, 93:8, 743–756, . doi:10.1080/09553002.2017.1312670. Nedostaje ili je prazan parametar
|title=(pomoć) - ^ S. Rosseland, Zeitschrift für Physik 14, 173 (1923).}-
- ^ L. Meitner (1922). „Über die Entstehung der β-Strahl-Spektren radioaktiver Substanzen”. Z. Phys. 9 (1): 131—144. Bibcode:1922ZPhy....9..131M. S2CID 121637546. doi:10.1007/BF01326962.
- ^ L. Meitner, Zeitschrift für Physik 17, 54 (1923).
- ^ -{P. Auger, Journal de Physique Radium 6, 205 (1925).
- ^ P. Auger: Sur les rayons β secondaires produits dans un gaz par des rayons X, C.R.A.S. 177 (1923) 169–171.
- ^ Duparc, Olivier Hardouin (2009). „Pierre Auger – Lise Meitner: Comparative contributions to the Auger effect”. International Journal of Materials Research. 100 (9): 1162—1166. S2CID 229164774. doi:10.3139/146.110163.
- ^ „The Auger Effect and Other Radiationless Transitions”. Cambridge University Press. Pristupljeno 2015-12-11.
Literatura
uredi- S. Macura; J. Radić-Perić (2004). Atomistika. Beograd: Fakultet za fizičku hemiju Univerziteta u Beogradu/Službeni list. str. 263.
- Miessler, Tarr, G.L. (1999). Inorganic Chemistry. Prentice-Hall.
- „Quantum Primer”. www.chem1.com. Pristupljeno 2015-12-11.
- „Periodic Trends”. Chemistry LibreTexts (na jeziku: engleski). 2013-10-02. Pristupljeno 2020-09-13.
- Miessler, Gary L.; Tarr, Donald A. (1999). Inorganic Chemistry (2nd izd.). Prentice Hall. str. 41. ISBN 0-13-841891-8.
- „Ionization Energy”. ChemWiki. University of California, Davis. 2013-10-02. Arhivirano iz originala 30. 04. 2010. g. Pristupljeno 10. 07. 2022.
- „Chapter 9: Quantum Mechanics”. faculty.chem.queesu.ca (na jeziku: engleski). 15. 1. 2018. Arhivirano iz originala 24. 07. 2020. g. Pristupljeno 31. 10. 2020.
- Stone, E.G. (19. 12. 2020v). „Atomic Structure : Periodic Trends”. Department of Chemistry. chem.tamu.edu (na jeziku: engleski). 400 Bizzell St, College Station, TX 77843, Texas, United States: Texas A&M University. Arhivirano iz originala 11. 10. 2018. g. Pristupljeno 19. 12. 2020.
- „Anomalous trends in ionization energy”. Chemistry Stack Exchange. Pristupljeno 2020-09-20.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry (8th izd.). Prentice Hall. str. 370. ISBN 0-13-014329-4.
- Grandinetti, Philip J. (8. 9. 2019). „Ionization Energy Trends | Grandinetti Group”. www.grandinetti.org. Pristupljeno 2020-09-13.
- Kent, Mr. „First Ionization Energy”. kentchemistry.com. KentChemistry. Pristupljeno 6. 12. 2020. „...The addition of the second electron into an already occupied orbital introduces repulsion between the electrons, thus it is easier to remove. that is why there is a dip in the ionization energy.”
- „Group IA”. chemed.chem.purdue.edu. Pristupljeno 2020-09-20.
- „Alkali Metals”. hyperphysics.phy-astr.gsu.edu. Pristupljeno 2020-09-13.
- „The Alkali Metals | Introduction to Chemistry”. courses.lumenlearning.com. Pristupljeno 2020-09-13.
- „Chemical elements listed by ionization energy”. lenntech.com. Lenntech BV. 2018. Pristupljeno 6. 12. 2020. „The elements of the periodic table sorted by ionization energy click on any element's name for further information on chemical properties, environmental data or health effects. This list contains the 118 elements of chemistry.”
- Boudreaux, K.A. (13. 8. 2020). „The Parts of the Periodic Table”. Department of Chemistry and Biochemistry. angelo.edu/faculty/kboudrea/ (na jeziku: engleski). 2601 W. Avenue N, San Angelo, TX 76909, Texas: Angelo State University. Arhivirano iz originala 10. 07. 2022. g. Pristupljeno 19. 12. 2020 — preko angelo.edu.
- „18.10: The Group 6A Elements”. Chemistry LibreTexts (na jeziku: engleski). 2014-07-02. Pristupljeno 2020-09-20.
- „Covalent Radius for all the elements in the Periodic Table”. periodictable.com. Pristupljeno 2020-09-13.
- Sikander (5. 12. 2015). „Why is ionisation energy of bismuth lower than lead?”. chemistry.stackexchange.com. Chemistry Stack Exchange. Pristupljeno 5. 12. 2020. „Why is ionisation enthalpy of Bismuth less than that of Lead for it just comes after the latter in periodic table?”
- Ball, Philip (21. 4. 2017). „The group 3 dilemma”. chemistryworld.com (na jeziku: engleski). Burlington House, Piccadilly, London: Chemistry World. Pristupljeno 18. 12. 2020 — preko Royal Society of Chemistry.
- Yirka, Bob (9. 4. 2015). „Measurement of first ionization potential of lawrencium reignites debate over periodic table”. General Physics. phys.org (na jeziku: engleski). Phys Org. Phys.org. Pristupljeno 13. 12. 2020. „Lawrencium, at this time, appears to have a dumb-bell shape. These new findings create conflicting views on where the element should be placed on the table and has reignited debate on the way the table is structured in general.”
- Scerri, Eric R.; Parsons, William (mart 2017). „What elements belong in group 3 of the periodic table?”. www.ionicviper.org. Ionic Viper. Pristupljeno 7. 12. 2020. „The question of precisely which elements should be placed in group 3 of the periodic table has been debated from time to time with apparently no resolution up to this point.”
- Sato, T. K.; Asai, M.; Borschevsky, A.; Stora, T.; Sato, N.; Kaneya, Y.; Tsukada, K.; Düllmann, Ch E.; Eberhardt, K.; Eliav, E.; Ichikawa, S.; Kaldor, U.; Kratz, J. V.; Miyashita, S.; Nagame, Y.; Ooe, K.; Osa, A.; Renisch, D.; Runke, J.; Schädel, M.; Thörle-Pospiech, P.; Toyoshima, A.; Trautmann, N. (april 2015). „Measurement of the first ionization potential of lawrencium, element 103”. Nature. 520 (7546): 209—211. Bibcode:2015Natur.520..209S. PMID 25855457. S2CID 4384213. doi:10.1038/nature14342.
- Singh, Jasvinder (1999). „Inert Gases”. Sterling Dictionary of Physics. Sterling Publishers Pvt. Ltd. str. 122. ISBN 978-81-7359-124-2.
- „Vanadium, Niobium and Tantalum”. Chemistry of the Elements. 1997. str. 976—1001. ISBN 978-0-7506-3365-9. doi:10.1016/B978-0-7506-3365-9.50028-6.
- Housecroft, C.E.; Sharpe, A.G. (1. 11. 1993). Inorganic Chemistry (eBook). Inorganic Chemistry (na jeziku: engleski). 3 (15th izd.). Switzerland: Pearson Prentice-Hall. str. 536, 649, 743. ISBN 978-0-273-74275-3. doi:10.1021/ed070pA304.1. Arhivirano iz originala 10. 07. 2022. g. Pristupljeno 14. 12. 2020.
- Billo, E. J. (1985). „Modern Inorganic Chemistry (Jolly, William L.)”. Journal of Chemical Education. 62 (4): A137. Bibcode:1985JChEd..62..137B. doi:10.1021/ed062pA137.1 .
Spoljašnje veze
uredi- Mahan, Bruce H. (1962). „Ionization Energy”. College of Chemistry, University of California Berkeley. Pristupljeno 2020-09-13.
- „Monatomic Gas - an overview | ScienceDirect Topics”. www.sciencedirect.com. Pristupljeno 2022-01-08.