Нитрат
Нитрати (V) су једињења која у себи садрже полиатомски јон NO3-. Соли које садрже овај јон називају се нитрати. Нитрати су уобичајене компоненте ђубрива и експлозива.[3] Готово сви неоргански нитрати су растворљиви у води. Пример нерастворљивог нитрата је бизмут оксинитрат.
| |
| Називи | |
|---|---|
| Системски IUPAC назив
Нитрат | |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| UNII | |
| |
| |
| Својства | |
| NO− 3 | |
| Моларна маса | 62,00 g·mol−1 |
| Конјугована киселина | Азотна киселина |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Структура нитрата (V)
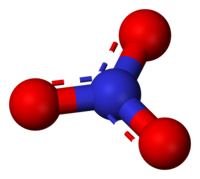
уредиСви нитрати (V) садрже NO3- јон. Атом азота је у стању хибридизације sp2. Хибридизоване орбитале граде σ везе са три атома кисеоника. Све N-O везе су исте дужине. Њихова дужина износи 124pm, а угао између њих 120°.
Овај јон је конјугована база азотне киселине, која се састоји од једног централног атома азота окруженог са три идентично везана атома кисеоника у тригоналном равном распореду. Нитратни јон носи формално наелектрисање од -1. Ово наелектрисање је резултат комбинације формалног наелектрисања у коме сваки од три кисеоника носи набој −2⁄3, док азот носи +1 набој, а све се то збраја и даје формално наелектрисањем полатомног нитратног јона. Овај аранжман се обично користи као пример резонанције. Попут изоелектронског карбонатног јона, нитратни јон може бити представљен резонантним структурама.
Општи подаци
уредиНитрати (V) су кристалне супстанције, растворљиве у води (изузеци су малобројни базни нитрати), имају јако оксидационо дејство. Ипак у растворима не поседују те особине.[4][5]
Нитрати се добијају услед реакције: азотна киселина + метал или оксид/хидрид/карбид метала.
У природи се могу јавити у облику минерал.
Нитрати налазе примену као минерална ђубрива, експлозивни материјали, у продукцији боја и у медицини.
За естре азотне киселине(V) уместо имена „нитрат(V) једињења“ (нпр. нитрат(V) целулозе) често се користи не баш исправан назив „нитроједињење“ (нпр. нитроцелулоза)
Примери
уреди- азотна киселина, HNO3
- натријум нитрат (чилска шалитра), NaNO3
- метил нитрат, CH3NO3
Дијетални нитрати
уредиБогат извор неорганског нитрата у исхрани људи потиче од лиснате зелене хране, као што су шпанаћ и рукола. NO−
3 (неоргански нитрат) је одржива активна компонента сока од цвекле и другог поврћа. Вода за пиће је такође њихов прехрамбени извор.[6] Прехрамбена нитратна суплементација даје позитивне резултате при тестирању перформанси вежби издржљивости.[7]
Конзумација великих доза нитрата било у облику чистог натријум нитрата или сока од цвекле код младих здравих особа брзо повећава концентрацију нитрата у плазми око 2-3 пута, а ова повишена концентрација нитрата може се одржавати најмање 2 недеље. Повећани ниво нитрата у плазми стимулише производњу азотног оксида. Азотни оксид је важан физиолошки сигнални молекул који се, између осталог, користи у регулацији протока крви у мишићима и митохондријској респирацији.[8]
Сушено месо
уредиКонзумација нитрита је првенствено одређена количином поједеног прерађеног меса, и концентрацијом нитрата у овом месу. Иако су нитрити азотно једињење које се углавном користи при сушењу меса, користе се и нитрати. Нитрати доводе до стварања нитрозамина.[9] Продукција канцерогених нитрозамина може се инхибирати употребом антиоксиданса витамина Ц и алфа-токоферолног облика витамина Е током сушења.[10]
Антихипертензивне дијете, као што је DASH дијета, типично садрже високе нивое нитрата, који се прво редукују до нитрита у пљувачци, као што се може детектовати пљувачним тестирањем, пре него што се формира азотни оксид.[6]
Појава и производња
уредиНитратне соли се природно налазе на земљи као велике наслаге, посебно нитратина, главног извора натријум нитрата.
Нитрате производе бројне врсте нитрификујућих бактерија у природном окружењу користећи амонијак или уреју као извор азота. Нитратна једињења за барут су се историјски производила, у одсуству извора минералних нитрата, различитим процесима ферментације помоћу урина и балеге.
Удари грома у земљину атмосфером богату азотом и кисеоником производе смешу азотних оксида који формирају азотне јоне и нитратне јоне који се кишом или окултним таложењем испирају из атмосфере.
Нитрати се индустријски производе полазећи од азотне киселине.[3]
Употребе
уредиНитрати се углавном производе за употребу као ђубриво у пољопривреди због њихове високе растворљивости и биоразградљивости. Главна нитратна ђубрива су амонијумске, натријумске, калијумске, калцијумске и магнезијумске соли. Годишње се у ту сврху произведе неколико милиона килограма.[3]
Друга велика примена нитрата је као оксидациона средства, нарочито у експлозивима, где брза оксидација једињења угљеника ослобађа велике количине гасова (види пример барута). Натријум нитрат се користи за уклањање ваздушних мехурића са растопљеног стакла и неке керамике. Смеше растопљене соли користе се за очвршћавање неких метала.[3]
Детекција
уредиСкоро све методе за откривање нитрата ослањају се на његову конверзију у нитрит, што је праћено нитрит-специфичним тестовима. Редукција нитрата у нитрит се врши бакар-кадмијумским материјалом. Узорак се уводи проточним инјективним анализатором, а настали ефлуент који садржи нитрит се затим комбинује са реагенсом за колориметријску или електрохемијску детекцију. Најпопуларнији од ових тестова је Грисов тест, при чему се нитрит претвара у дубоко обојену азо боју, погодну за УВ-визуелну спектроскопску анализу. Метода користи реактивност азотасте киселине добијене закисељавањем нитрита. Азотаста киселина селективно реагује са ароматичним аминима дајући диазонијумске соли, које се затим удружују са другим реагенсом дајући азо боју. Граница детекције је 0,02 до 2 μМ.[11] Методе су високо прилагођене биолошким узорцима.[12]
Безбедност
уредиАкутна токсичност нитрата је ниска. Постоји „значајно неслагање“ у погледу дугорочних ризика изложености нитратима. Две области могућих разулога за забринутост су да (i) нитрат може бити претеча нитрита у доњем делу црева, а нитрит је претеча нитрозамина, за које се сматра да учествују у карциногенези, и (ii) нитрат је учествује у метемоглобинемији, поремећају хемоглобина црвених крвних зрнаца.[13][14]
Метемоглобинемија
уредиНитрати не утичу на новорођенчад и труднице.[15][16] Синдром поплавеле бебе узрокован је низом других фактора као што су желучане тегобе, попут дијареје, инфекције, нетолеранције на протеине, токсичности тешких метала итд, при чему нитрати играју мању улогу.[17]
Стандарди воде за пиће
уредиЗаконом о безбедној води за пиће, Агенција за заштиту животне средине у САД поставила је максимални ниво контаминације од 10nbsp;mg/L или 10 ppm нитрата у води за пиће.[18]
Прихватљиви дневни унос (ADI) нитратних јона успостављњен је у распону од 0–3,7 mg (kg телесне тежине)−1 дан−1 од стране Заједничког FAO/WHO експертног комитета за прехрамбене адитиве (JEFCA).[19]
Акватична токсичност
уредиУ слатководним или естуарским системима у близини копна, нитрат може достићи концентрације које су смртоносне за рибе. Иако је нитрат много мање токсичан од амонијака,[20] нивои преко 30 ppm нитрата могу инхибирати раст, оштетити имунски систем и изазвати стрес код неких водених врста.[21] Токсичност нитрата остаје предмет расправе.[22]
У већини случајева прекомерних концентрација нитрата у воденим системима, примарни извори су испуштања отпадних вода, као и површинско отицање из пољопривредних или уређених подручја на којима су примењене велике количине нитратног ђубрива. Резултирајућа еутрофикација и цветање алги резултирају аноксијом и мртвим зонама. Као последица тога, како нитрат чини компоненту укупних растворених чврстих супстанци, оне се широко користе као показатељ квалитета воде.
Види још
уреди- Амонијум
- Нитрификација
- Нитрит, анјон NO−
2 - Азотни оксиди
- Натријум нитрат
Референце
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б в г „Nitrates and Nitrites”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. doi:10.1002/14356007.a17_265.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
- ^ а б Hord NG, Tang Y, Bryan NS (јул 2009). „Food sources of nitrates and nitrites: the physiologic context for potential health benefits”. The American Journal of Clinical Nutrition. 90 (1): 1—10. PMID 19439460. doi:10.3945/ajcn.2008.27131 .
- ^ McMahon NF, Leveritt MD, Pavey TG (април 2017). „The Effect of Dietary Nitrate Supplementation on Endurance Exercise Performance in Healthy Adults: A Systematic Review and Meta-Analysis” (PDF). Sports Medicine (Auckland, N.Z.). 47 (4): 735—756. PMID 27600147. S2CID 207494150. doi:10.1007/s40279-016-0617-7.
- ^ Maughan, Ronald J (2013). Food, Nutrition and Sports Performance III. New York: Taylor & Francis. стр. 63. ISBN 978-0-415-62792-4.
- ^ Bingham SA, Hughes R, Cross AJ (новембар 2002). „Effect of white versus red meat on endogenous N-nitrosation in the human colon and further evidence of a dose response”. The Journal of Nutrition. 132 (11 Suppl): 3522S—3525S. PMID 12421881. doi:10.1093/jn/132.11.3522S .
- ^ Parthasarathy DK, Bryan NS (новембар 2012). „Sodium nitrite: the "cure" for nitric oxide insufficiency”. Meat Science. 92 (3): 274—9. PMID 22464105. doi:10.1016/j.meatsci.2012.03.001.
- ^ Moorcroft, M.; Davis, J.; Compton, R. G. (2001). „Detection and determination of nitrate and nitrite: A review”. Talanta. 54 (5): 785—803. PMID 18968301. doi:10.1016/S0039-9140(01)00323-X.
- ^ Ellis, Graham; Adatia, Ian; Yazdanpanah, Mehrdad; Makela, Sinikka K. (1998). „Nitrite and Nitrate Analyses: A Clinical Biochemistry Perspective”. Clinical Biochemistry. 31 (4): 195—220. PMID 9646943. doi:10.1016/S0009-9120(98)00015-0.
- ^ Powlson, David S.; Addiscott, Tom M.; Benjamin, Nigel; Cassman, Ken G.; De Kok, Theo M.; Van Grinsven, Hans; l'Hirondel, Jean-Louis; Avery, Alex A.; Van Kessel, Chris (2008). „When Does Nitrate Become a Risk for Humans?”. Journal of Environmental Quality. 37 (2): 291—5. PMID 18268290. doi:10.2134/jeq2007.0177.
- ^ „Nitrate and Nitrite Poisoning: Introduction”. The Merck Veterinary Manual. Приступљено 2008-12-27.
- ^ Addiscott, T.M.; Benjamin, N. (2006). „Nitrate and human health”. Soil Use and Management. 20 (2): 98—104. doi:10.1111/j.1475-2743.2004.tb00344.x.
- ^ A. A (јул 1999). „Avery: Infant Methemoglobinemia - Reexamining the Role of Drinking Water Nitrates,”. Environmental Health Perspectives. 107 (7). Спољашња веза у
|title=(помоћ). - ^ Manassaram DM, Backer LC, Messing R, Fleming LE, Luke B, Monteilh CP (октобар 2010). „Nitrates in drinking water and methemoglobin levels in pregnancy: a longitudinal study”. Environmental Health (на језику: енглески). 9 (1): 60. PMC 2967503 . PMID 20946657. doi:10.1186/1476-069x-9-60.
- ^ „4. What are EPA's drinking water regulations for nitrate?”. Ground Water & Drinking Water (на језику: енглески). Архивирано из оригинала 28. 03. 2019. г. Приступљено 2018-11-13.
- ^ Bagheri, H.; Hajian, A.; Rezaei, M.; Shirzadmehr, A. (2017). „Composite of Cu metal nanoparticles-multiwall carbon nanotubes-reduced graphene oxide as a novel and high performance platform of the electrochemical sensor for simultaneous determination of nitrite and nitrate”. Journal of Hazardous Materials. 324 (Pt B): 762—772. PMID 27894754. doi:10.1016/j.jhazmat.2016.11.055.
- ^ Romano N, Zeng C (септембар 2007). „Acute toxicity of sodium nitrate, potassium nitrate, and potassium chloride and their effects on the hemolymph composition and gill structure of early juvenile blue swimmer crabs(Portunus pelagicus Linnaeus, 1758) (Decapoda, Brachyura, Portunidae)”. Environmental Toxicology and Chemistry. 26 (9): 1955—62. PMID 17705664. doi:10.1897/07-144r.1.
- ^ Sharpe, Shirlie. „Nitrates in the Aquarium”. About.com. Архивирано из оригинала 24. 07. 2011. г. Приступљено 30. 10. 2013.
- ^ Romano N, Zeng C (децембар 2007). „Effects of potassium on nitrate mediated alterations of osmoregulation in marine crabs”. Aquatic Toxicology. 85 (3): 202—8. PMID 17942166. doi:10.1016/j.aquatox.2007.09.004.
Спољашње везе
уреди- ATSDR - Case Studies in Environmental Medicine - Nitrate/Nitrite Toxicity
- „Nitrate Risk in Forage Crops - Frequently Asked Questions”. Agriculture and Rural Development. Government of Alberta. Приступљено 30. 10. 2013.