Hidroksid
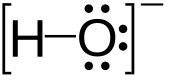
Hidroksidi su jedinjenja tipa M(OH)x koja disocijacijom daju hidroksidne jone.[3] Hidroksidi mogu da budu bazni ili amfoterni.[4] Hidroksid je isto tako diatomski anjon sa hemijskom formulom OH−. Hidroksid se sastoji od atoma kiseonika i vodonika koje drži zajedno kovalentna veza, i nosi negativan električni naboj. Ovaj jon je važan, ali obično neznatno zastupljeni sastojak vode. On funkcioniše kao baza, ligand, nukleofil i katalizator. Hidroksidni jon formira soli, od kojih neke disociraju u vodenom rastvoru, oslobađajući solvatirane hidroksidne jone. Natrijum hidroksid je hemijska supstanca koja se proizvodi u količinama od više miliona tona godišnje. Hidroksid vezan za snažno elektropozitivni centar može i sam da se jonizuje, oslobađajući vodonični katjon (H+), čineći matično jedinjenje kiselinom.
| |
| Nazivi | |
|---|---|
| Sistemski IUPAC naziv
Hidroksid | |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| UNII | |
| |
| |
| Svojstva | |
| OH− | |
| Molarna masa | 17,01 g·mol−1 |
| Konjugovana kiselina | Voda |
| Konjugovana baza | Oksidni anjon |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Korespondirajuće električno neutralno jedinjenje HO• je hidroksilni radikal. Korespondirajuća kovalentno vezana grupa –OH atoma je hidroksilna grupa. Hidroksidni joni i hidroksi grupa su nukleofili i mogu delovati kao katalizatori u organskoj hemiji.
Mnoge neorganske materije koje u svom nazivu nose reč „hidroksid” nisu jonska jedinjenja hidroksidnog jona, već kovalentna jedinjenja koja sadrže hidroksi grupe.
Hidroksidni jon
urediHidroksidni jon je prirodni deo vode, zbog reakcije samojonizacije u kojoj njegov komplement, hidronijum, prima vodonik:[5]
- H3O+ + OH− ⇌ 2H2O
Konstanta ravnoteže za ovu reakciju, definisana kao
- Kw = [H+][OH−][note 1] ima vrednost od 10−14 na 25 °C, tako da je koncentracija hidroksidnih jona u čistoj vodi blizo 10−7 mol∙dm−3, da bi se zadovoljilo ograničenje jednakog naboja. pH vrednost rastvora je jednaka sa decimalnim kologaritmom koncentracije vodoničnih katjona;[note 2] pH vrednost čiste vode je 7 na sobnoj temperaturi. Koncentracija hidroksidnih jona se može izraziti kao funkcija pOH, koja je (14 − pH),[note 3] tako da je pOH čiste vode takođe jednak 7. Dodatak baze u vodu redukuje koncentraciju vodoničnih jona i stoga se povećava koncentracija hidroksidnih jona (povećava se pH, i smanjuje pOH) čak i ako sama baza ne sadrži hidroksid. Na primer, rastvori amonijaka imaju pH vrednost veću od 7 usled reakcije NH3 + H+ ⇌ NH+
4, kojom se smanjuje koncentracija vodoničnih katjona, što dovodi do povećanja koncentracije hidroksidnih jona. pOH se može održavati na skoro konstantnoj vrednosti pomoću raznih puferskih rastvora.
U vodenom rastvoru[7] hidroksidni jon je baza u Brensted–Laurijevom smislu jer može da primi proton[note 4] od Brensted–Laurijeve kiseline i da formira molekul vode. On isto tako može da deluje kao Luisova baza donirajući elektronski par Luisovoj kiselini. U vodenom rastvoru su vodonikovi i hidroksilni joni snažno rastvoreni, sa vodoničnim vezama između atoma kiseonika i vodonika. Bihidroksidni jon H
3O−
2 je okarakterisano u čvrstom stanju. Ovo jedinjenje je centrosimetrično i ima veoma kratku vodoničnu vezu (114,5 pm) koja je slične dužine kao u bifluoridnom jonu HF−
2 (114 pm).[6] U vodenom rastvoru hidroksidni jon formira snažne vodonične veze sa molekulama vode. Posledica toga je da koncentrovani rastvor natrijum hidroksida ima visoku viskoznost usled stvaranja proširene mreže vodoničnih veza kao u rastvorima fluorovodonika.
U rastvoru, izloženom vazduhu, hidroksidni jon brzo reaguje sa atmosferskim ugljen-dioksidom, koji deluje kao kiselina, te se inicijalno formira bikarbonatni jon.
- OH− + CO2 ⇌ HCO−
3
Konstanta ravnoteže za ovu reakciju može da bude navedena bilo kao reakcija sa rastvorenim ugljen dioksidom ili kao reakcija sa gasovitim ugljen dioksidom (pogledajte ugljenu kiselinu za vrednosti i detalje). Na neutralnoj i kiselim pH vrednostima, reakcija je spora, ali je katalizuje enzim karbonatna dehidrataza, koji efektivno stvara hidroksidne jone u svom aktivnom mestu.
Rastvori koji sadrže hidroksidne jone napadaju staklo. U ovom slučaju silikati u staklu deluju kao kiseline. Bazni hidroksidi, bili čvrsti ili rastvoreni, čuvaju se u hermetički zatvorenim plastičnim posudama.
Hidroksidni jon može da funkcioniše kao tipičan ligand koji donira elektronski par, formirajući takve komplekse kao što je tetrahidroksoaluminat/tetrahidroksidoaluminat [Al(OH)4]−. Takođe se često nalazi u kompleksima mešovitih liganda tipa [MLx(OH)y]z+, gde je L ligand. Hidroksidni jon često služi kao premošćavajući ligand, donirajući jedan par elektrona svakom od atoma koji se premošćavaju. Kao što ilustruje jon [Pb2(OH)]3+, metalni hidroksidi se često pišu u pojednostavljenom formatu. Hidroksid čak može da deluje i kao donator 3 para elektrona, kao u tetrameru [PtMe3(OH)]4.[8]
Kada su vezani za metalni centar sa snažnim povlačenjem elektrona, hidroksidni ligandi imaju tendenciju da se jonizuju u oksidne ligande. Na primer, bihromatni jon [HCrO4]− se disocira u skladu sa
- [O3CrO–H]− ⇌ [CrO4]2− + H+ sa pKa od oko 5,9.[9]
Vibracioni spektri
urediInfracrveni spektri jedinjenja koja sadrže –OH funkcionalnu grupu imaju jak apsorpcioni opseg u regionu centriranom oko 3500 cm−1.[10] Visoka frekvencija molekulskih vibracija posledica je male mase atoma vodonika u poređenju sa masom atoma kiseonika, što relativno lako otkriva hidroksilne grupe pomoću infracrvene spektroskopije. Traka usled OH grupe je obično oštra. Međutim, širina opsega se povećava kada OH grupa učestvuje u vezivanju vodonika. Molekul vode ima HOH savijajući mod na oko 1600 cm−1, tako da se odsustvo ovog opsega može koristi za razlikovanje OH grupe od molekula vode.
Kada je OH grupa vezana za metalni jon u koordinacionom kompleksu, može se uočiti režim savijanja M−OH. Na primer, u [Sn(OH)6]2− opseg se javlja na 1065 cm−1. Mod savijanja za premošćavajući hidroksid ima tendenciju pojavljivanja na nižoj frekvenciji, kao u [(bipiridin)Cu(OH)2Cu(bipiridin)]2+ (955 cm−1).[11] M−OH vibracije istezanja se javljaju ispod 600 cm−1. Na primer, tetraedarski jon [Zn(OH)4]2− ima opsege na 470 cm−1 (Raman-aktivan, polarizovan) i 420 cm−1 (infracrveni). Isti jon ima (HO)–Zn–(OH) vibraciju savijanja na 300 cm−1.[12]
Primene
urediRastvori natrijum hidroksida, takođe poznati kao lužina i kaustična soda, koriste se u proizvodnji pulpe i papira, tekstila, pitke vode, sapuna i deterdženata i kao sredstvo za čišćenje odvoda. Svetska proizvodnja u 2004. godini je bila približno 60 miliona tona.[13] Glavni način proizvodnje je hloralkalni postupak.
Rastvori koji sadrže hidroksidni jon nastaju kada se so slabe kiseline rastvara u vodi. Natrijum karbonat se koristi kao alkalija, na primer, zahvaljujući reakciji hidrolize
- CO2−
3 + H2O ⇌ HCO−
3 + OH− (pKa2= 10,33 na 25 °C i nulta jonska jačina)
Iako je bazna jačina rastvora natrijum karbonata niža od koncentrovanog rastvora natrijum hidroksida, njegova prednost je što je čvrsta supstanca. Natrijum karbonat se takođe proizvodi u ogromnim razmerama (42 miliona tona u 2005. godini) Solvejevim postupkom.[14] Primer upotrebe natrijum karbonata kao alkalije je kada soda za pranje (drugo ime za natrijum karbonat) deluje na nerastvorljive estere, poput triglicerida, široko poznate kao masti, da ih hidrolizuje i učini rastvorljivim.
Boksit, bazni hidroksid aluminijuma, glavna je ruda od koje se proizvodi metal.[15] Slično tome, getit (α-FeO(OH)) i lepidokrokit (γ-FeO(OH)), bazni hidroksidi gvožđa, su među glavnim rudama koje se koriste za proizvodnju metalnog gvožđa.[16] Postoji i niz drugih upotreba.
Pregled hidroksida
uredi- Hidroksidi metala 1. grupe hemijskih elemenata: LiOH, NaOH, KOH, RbOH, CsOH. Ovi hidroksidi su veoma jake baze koji odlično rastvaraju u vodi. Ova jedinjenja su hemijski veoma reaktivna. Disosuju na jon metala i anjon OH-
- Hidroksidi metala 2. grupe hemijskih elemenata bez berilijuma: Mg(OH)2, Ca(OH)2, Sr(OH)2 i Ba(OH)2. Ova jedinjenja su dosta jake baze, ali se ne rastvaraju baš najbolje u vodi.
- Amfoterni hidroksidi: Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3. Ovi hidroksidi se loše rastvaraju u vodi. U kiseloj sredini disosuju na jon metala i na anjone OH-. U baznoj sredini na anjon XOnn- i na katjone H+.
Karakter hidroksida zavisi od veze. Ukoliko je jaka jonska veza dobijaju se hidroksidi koji u potpunosti disosuju na jone OH-. Ukoliko je veza više kovalentna hidroksid ima amfoterne osobine.
Napomene
uredi- ^ [H+] označava koncentraciju vodonikovih katjona i [OH−] koncentraciju hidroksidnih jona
- ^ Strogo gledano pH je kologaritam aktivnosti vodoničnog katjona
- ^ pOH označava negativnu vrednost logaritma osnove 10 od [OH−], alternativno logaritam od 1/[OH−]
- ^ U ovom kontekstu, proton je termin koji se koristi za solvatirani vodonični katjon
Izvori
uredi- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ Geissler, P. L.; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. (2001). „Autoionization in liquid water” (PDF). Science. 291 (5511): 2121—2124. Bibcode:2001Sci...291.2121G. CiteSeerX 10.1.1.6.4964 . PMID 11251111. doi:10.1126/science.1056991. Arhivirano iz originala (PDF) 25. 06. 2007. g. Pristupljeno 26. 10. 2019.
- ^ a b Kamal Abu-Dari; Kenneth N. Raymond; Derek P. Freyberg (1979). „The bihydroxide (H
3O−
2) anion. A very short, symmetric hydrogen bond”. J. Am. Chem. Soc. 101 (13): 3688—3689. doi:10.1021/ja00507a059. - ^ Marx, D.; Chandra, A; Tuckerman, M.E. (2010). „Aqueous Basic Solutions: Hydroxide Solvation, Structural Diffusion, and Comparison to the Hydrated Proton”. Chem. Rev. 110 (4): 2174—2216. PMID 20170203. doi:10.1021/cr900233f.
- ^ Greenwood, str. 1168
- ^ IUPAC SC-Database Arhivirano na sajtu Wayback Machine (19. jun 2017) A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ Nakamoto, K. (1997). Infrared and Raman spectra of Inorganic and Coordination compounds. Part A (5th izd.). Wiley. ISBN 978-0-471-16394-7.
- ^ Nakamoto, Part B, p. 57
- ^ Adams, D.M. (1967). Metal–Ligand and Related Vibrations. London: Edward Arnold. Chapter 5.
- ^ Cetin Kurt (2005). „Sodium Hydroxide”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_345.pub2.
- ^ Kostick, Dennis (2006). "Soda Ash", chapter in 2005 Minerals Yearbook, United States Geological Survey.
- ^ Emsley, John (2001). „Aluminium”. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, UK: Oxford University Press. str. 24. ISBN 978-0-19-850340-8.
- ^ Emsley, John (2001). „Aluminium”. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, UK: Oxford University Press. str. 209. ISBN 978-0-19-850340-8.
Literatura
uredi- Holleman, A.F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic press. ISBN 978-0-12-352651-9.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II izd.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- Shriver, D.F; Atkins, P.W (1999). Inorganic Chemistry (3rd izd.). Oxford: Oxford University Press. ISBN 978-0-19-850330-9.
- Wells, A.F (1962). Structural Inorganic Chemistry (3rd. izd.). Oxford: Clarendon Press. ISBN 978-0-19-855125-6.