Kalijum-hidroksid
Kalijum-hidroksid (molekulska formula KOХ) je hidroksid kalijuma, i jedna od najjačih baza.[12][13]
| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
Kalijum hidroksid
| |
| Drugi nazivi
Kaustična potaša , lug, kalijev lug, kalijum, kalijum-hidrat, KOH
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.013.802 |
| EC broj | 215-181-3 |
| E-brojevi | E525 (regulator kiselosti, ...) |
| RTECS | TT2100000 |
| UNII | |
| UN broj | 1813 |
| |
| |
| Svojstva | |
| KOH | |
| Molarna masa | 56,11 g mol−1 |
| Agregatno stanje | bela čvrsta materija, higroskopna |
| Miris | bez mirisa |
| Gustina | 2,044 g/cm3 (20 °C)[3] 2,12 g/cm3 (25 °C)[4] |
| Tačka topljenja | 360[5] °C (680 °F; 633 K) |
| Tačka ključanja | 1.327 °C (2.421 °F; 1.600 K) |
| 85 g/100 mL (-23,2 °C) 97 g/100 mL (0 °C) 121 g/100 mL (25 °C) 138,3 g/100 mL (50 °C) 162,9 g/100 mL (100 °C)[3][6] | |
| Rastvorljivost | rastvoran u alkoholu, glicerolu nerastvoran u etru, tečnom amonijaku |
| Rastvorljivost u metanol | 55 g/100 g (28 °C)[4] |
| Rastvorljivost u izopropanol | ~14 g / 100 g (28 °C) |
| Baznost (pKb) | −0,7[7](KOH(aq) = K+ + OH–) |
| Magnetna susceptibilnost | −22,0·10−6 cm³/mol |
| Indeks refrakcije (nD) | 1,409 (20 °C) |
| Struktura | |
| Kristalna rešetka/struktura | heksagonalna |
| Termohemija | |
| Specifični toplotni kapacitet, C | 65,87 J/mol·K[4] |
Standardna molarna
entropija (S |
79,32 J/mol·K[4][8] |
Standardna entalpija
stvaranja (ΔfH |
-425,8 kJ/mol[4][8] |
Gibsova slobodna energija (ΔfG˚)
|
-380,2 kJ/mol[4] |
| Opasnosti | |
| Bezbednost prilikom rukovanja | ICSC 0357 |
| GHS piktogrami |   [9] [9]
|
| GHS signalne reči | Danger |
| H302, H314[9] | |
| P280, P305+351+338, P310[9] | |
| NFPA 704 | |
| Tačka paljenja | nezapaljiv |
| Smrtonosna doza ili koncentracija (LD, LC): | |
LD50 (srednja doza)
|
273 mg/kg (oralno, pacov)[11] |
| Granice izloženosti zdravlja u SAD (NIOSH): | |
PEL (дозвољено)
|
none[10] |
REL (preporučeno)
|
C 2 mg/m3[10] |
IDLH (trenutna opasnost)
|
N.D.[10] |
| Srodna jedinjenja | |
Drugi anjoni
|
Kalijum hidrosulfid kalijum amid |
Drugi katjoni
|
Litijum hidroksid natrijum hidroksid rubidijum hidroksid cezijum hidroksid |
Srodna jedinjenja
|
kalijum oksid |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25°C [77°F], 100 kPa). | |
| Reference infokutije | |
Pri normalnim uslovima kalijum-hidroksid je čvrsta supstanca bele boje gustine 2,04 g/cm³. Obično se proizvodi u obliku mekih kristalnih listića ili granula. Veoma dobro je rastvorljiv u vodi npr. na temperaturi od 0 °C 97 g na 100 cm³, a na 20 °C 110 g na 100 cm³ H2O. Proces rastvaranja je egzoterman. Temperatura topljenja kalijum hidroksida je 406+ °C a temperatura ključanja 1320 °C. Kalijum hidroksid i njegov vodeni rastvor prima iz vazduha ugljen-dioksid gradeći kalijum karbonat. Kalijum hidroksid nagriza kožu i izaziva ozbiljne rane.[14] LD50 (pacov, preko usta) iznosi 250 - 400 mg/kg.
Njegova molekulska masa je 56,1 u.
Dobija se reakcijom kalijuma sa vodom. U većim količinama dobija se elektrolizom rastvora kalijum hlorida. Pre se dobijao rastvaranjem pepela u vodi ali takav kalijum-hidroksid nije bio potpuno čist.
Kalijum-hidroksid se koristi za proizvodnju sapuna, u organskim sintezama kao jaka baza i u sredstvima za čišćenje cevi.
Svojstva i struktura
urediKOH pokazuje visoku termičku stabilnost. Zbog svoje visoke stabilnosti i relativno niske tačke topljenja, često se lije u obliku peleta ili šipki, oblika koji imaju malu površinu i pogodna svojstva za rukovanje. Ove pelete postaju lepljive na vazduhu jer je KOH higroskopan. Većina komercijalnih uzoraka je oko 90% čisto, ostatak čine voda i karbonati.[14] Njegovo rastvaranje u vodi je jako egzotermno. Koncentrovani vodeni rastvori se ponekad nazivaju kalijumovim lužinama. Čak i na visokim temperaturama, čvrsti KOH se ne dehidrira lako.[15]
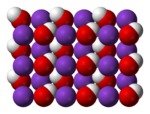
Struktura
urediNa višim temperaturama, čvrsti KOH se kristalizuje u kristalnoj strukturi NaCl. OH grupa biva brzo ili nasumično poremećena tako da je OH− grupa efektivno sferni anjon poluprečnika 1,53 Å (između veličine Cl−
i F−
). Na sobnoj temperaturi, OH− grupe su uređene i okruženje oko K+
centara je izobličeno, sa K+
—OH−
rastojanjima u rasponu od 2,69 do 3,15 Å, u zavisnosti od orijentacije OH grupe. KOH formira niz kristalnih hidrata, i to monohidrat KOH • H2O, dihidrat KOH • 2H2O i tetrahidrat KOH • 4H2O.[16]
Reakcije
urediRastvorljivost i svojstva isušivanja
urediOko 121 g KOH se rastvori u 100 mL vode na sobnoj temperaturi, što je u suprotnosti sa 100 g/100 mL za NaOH. Dakle, na molarnoj osnovi, NaOH je malo rastvorljiviji od KOH. Alkohol niže molekularne težine kao što su metanol, etanol i propanoli su takođe odlični rastvarači. Oni učestvuju u kiselinsko-baznoj ravnoteži. U slučaju metanola, kalijum metoksid (metilat) formira:[17]
- KOH + CH3OH CH3OK + H
2O
Zbog svog visokog afiniteta prema vodi, KOH služi kao desikant u laboratoriji. Često se koristi za sušenje osnovnih rastvarača, posebno amina i piridina.
Kao nukleofil u organskoj hemiji
urediKOH, kao i NaOH, služi kao izvor OH−, visoko nukleofilnog anjona koji napada polarne veze u neorganskim i u organskim materijalima. Vodeni KOH saponifikuje estre:
- KOH + RCOOR' → RCOOK + R'OH
Kada je R dugačak lanac, proizvod se naziva kalijumski sapun. Ova reakcija se manifestuje „masnim“ osećajem koji KOH daje kada se dodirne — masti na koži se brzo pretvaraju u sapun i glicerol.
Rastopljeni KOH se koristi za zamenjivanje halogenida i drugih odlazećih grupa. Reakcija je posebno korisna za aromatične reagense da daju odgovarajuće fenole.[18]
Reakcije sa neorganskim jedinjenjima
urediKomplementarno svojoj reaktivnosti prema kiselinama, KOH napada okside. Dakle, SiO2 biva napadnut sa KOH dajući rastvorljive kalijum silikate. KOH reaguje sa ugljen-dioksidom dajući kalijum bikarbonat:
- KOH + CO2 → KHCO3
Proizvodnja
urediIstorijski gledano, KOH je pravljen dodavanjem kalijum karbonata u jak rastvor kalcijum hidroksida (gašeni kreč). Reakcija metateze soli dovodi do taloženja čvrstog kalcijum karbonata, ostavljajući kalijum hidroksid u rastvoru:
- Ca(OH)2 + K2CO3 → CaCO3 + 2 KOH
Filtriranjem istaloženog kalcijum karbonata i ključanjem rastvora dobija se kalijum hidroksid („kalcinisana ili kaustična potaša“). Ova metoda proizvodnje kalijum hidroksida je ostala dominantna sve do kasnog 19. veka, kada je u velikoj meri zamenjena sadašnjom metodom elektrolize rastvora kalijum hlorida.[14] Metoda je analogna proizvodnji natrijum hidroksida (pogledajte hloralkalni proces):
- 2 KCl + 2 H2O → 2 KOH + Cl2 + H2
Gas vodonik se formira kao nusproizvod na katodi; istovremeno se odvija anodna oksidacija hloridnog jona, formirajući gasoviti hlor kao nusprodukt. Odvajanje anodnog i katodnog prostora u ćeliji za elektrolizu je od suštinskog značaja za ovaj proces.[19]
Upotrebe
urediKOH i NaOH se mogu koristiti naizmenično za brojne primene, iako je u industriji poželjniji NaOH zbog niže cene.
Prekurzor drugih jedinjenja kalijuma
urediMnoge kalijumove soli se pripremaju reakcijama neutralizacije koje uključuju KOH. Kalijumove soli karbonata, cijanida, permanganata, fosfata i raznih silikata se pripremaju tretiranjem oksida ili kiselina sa KOH.[14] Visoka rastvorljivost kalijum fosfata je poželjna u đubrivima.
Proizvodnja mekih sapuna
urediSaponifikacija masti sa KOH se koristi za pripremu odgovarajućih „kalijumskih sapuna”, koji su mekši od uobičajenih sapuna dobijenih primenom natrijum hidroksida. Zbog svoje mekoće i veće rastvorljivosti, kalijumovi sapuni zahtevaju manje vode da bi se rastopili i stoga mogu da sadrže više sredstva za čišćenje nego tečni natrijum sapuni.[20]
Kao elektrolit
urediVodeni rastvor kalijum hidroksida se koristi kao elektrolit u alkalnim baterijama na bazi nikl-kadmijuma, nikl-vodonika i mangan-dioksida-cinka. Kalijum hidroksid je poželjniji u odnosu na natrijum hidroksid jer su njegovi rastvori provodljiviji.[21] Nikl-metal hidridne baterije u Tojoti Prajus koriste mešavinu kalijum hidroksida i natrijum hidroksida.[22] Nikl-gvozdene baterije takođe koriste kalijum hidroksidni elektrolit.
Prehrambena industrija
urediU prehrambenim proizvodima, kalijum hidroksid deluje kao zgušnjivač hrane, sredstvo za kontrolu pH i stabilizator hrane. FDA ga smatra generalno bezbednim kao direktan sastojak hrane kada se koristi u skladu sa dobrom proizvođačkom praksom.[23] U E brojevnom sistemu je poznat kao E525.
Specijalizovane aplikacije
urediKao i natrijum hidroksid, kalijum hidroksid nalazi primenu brojnim specijalizovanim okolnositma, od kojih se praktično svi vidovi primene oslanjaju na njegova svojstva jake hemijske baze sa posledičnom sposobnošću da razgradi mnoge materijale. Na primer, u procesu koji se obično naziva „hemijska kremacija“ ili „resomacija“, kalijum hidroksid ubrzava razgradnju mekih tkiva, životinjskih i ljudskih, da bi za sobom ostavio samo kosti i druga tvrda tkiva.[24] Entomolozi koji žele da proučavaju finu strukturu anatomije insekata mogu koristiti 10% vodeni rastvor KOH da bi primenili ovaj proces.[25]
Reference
uredi- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ a b Lide, D. R., ur. (2005). CRC Handbook of Chemistry and Physics (86th izd.). Boca Raton (FL): CRC Press. str. 4-80. ISBN 0-8493-0486-5.
- ^ a b v g d đ „potassium hydroxide”. chemister.ru. Arhivirano iz originala 18. 5. 2014. g. Pristupljeno 8. 5. 2018.
- ^ „A18854 Potassium hydroxide”. Alfa Aesar. Thermo Fisher Scientific. Arhivirano iz originala 19. 10. 2015. g. Pristupljeno 26. 10. 2015.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Pristupljeno 2014-05-29.
- ^ Popov, K.; et al. (2002). „7Li, 23Na, 39K and 133Cs NMR comparative equilibrium study of alkali metal cation hydroxide complexes in aqueous solutions. First numerical value for CsOH formation”. Inorganic Chemistry Communications. 3 (5): 223—225. ISSN 1387-7003. doi:10.1016/S1387-7003(02)00335-0. Pristupljeno 20. 10. 2018.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. str. A22. ISBN 978-0-618-94690-7.
- ^ a b v Sigma-Aldrich Co. Retrieved on 2014-05-18.
- ^ a b v NIOSH Džepni vodič hemijskih hazarda. „#0523”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ Chambers, Michael. „ChemIDplus - 1310-58-3 - KWYUFKZDYYNOTN-UHFFFAOYSA-M - Potassium hydroxide [JAN:NF] - Similar structures search, synonyms, formulas, resource links, and other chemical information.”. chem.sis.nlm.nih.gov. Arhivirano iz originala 12. 8. 2014. g. Pristupljeno 8. 5. 2018.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st izd.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ a b v g Schultz, Heinz; Bauer, Günter; Schachl, Erich; Hagedorn, Fritz; Schmittinger, Peter (2005). „Potassium Compounds”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, Germany: Wiley-VCH. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a22_039.
- ^ Holleman, A. F; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ Wells, A.F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 978-0-19-855370-0.
- ^ Platonov, Andrew Y.; Kurzin, Alexander V.; Evdokimov, Andrey N. (2009). „Composition of Vapor and Liquid Phases in the Potassium Hydroxide + Methanol Reaction System at 25 °C”. J. Solution Chem. 39 (3): 335—342. S2CID 97177429. doi:10.1007/s10953-010-9505-1.
- ^ W. W. Hartman (1923). „p-Cresol”. Org. Synth. 3: 37. doi:10.15227/orgsyn.003.0037.; Coll. Vol., 1, str. 175
- ^ Römpp Chemie-Lexikon, 9th Ed. (in German)
- ^ K. Schumann; K. Siekmann (2005). „Soaps”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 978-3527306732. doi:10.1002/14356007.a24_247.
- ^ D. Berndt; D. Spahrbier (2005). „Batteries”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 978-3527306732. doi:10.1002/14356007.a03_343.
- ^ „Toyota Prius Hybrid 2010 Model Emergency Response Guide” (PDF). Toyota Motor Corporation. 2009. Arhivirano iz originala (PDF) 2012-03-20. g.
- ^ „Compound Summary for CID 14797 - Potassium Hydroxide”. PubChem.
- ^ Green, Margaret (januar 1952). „A RAPID METHOD FOR CLEARING AND STAINING SPECIMENS FOR THE DEMONSTRATION OF BONE”. The Ohio Journal of Science. 52 (1): 31—33. hdl:1811/3896.
- ^ Eisner, Thomas (2003). For the Love of Insects. Harvard University Press. str. 71.
