Етил група
Етил група је алкилни супституент који настаје од етана (C2H6). Формула је –C H2CH3, уз врло честу скраћеницу ет. Ознака етил у ИУПАЦ номенклатури органске хемије се узима за засићене двоугљеничне функционалне групе у молекулу, док префикс ет означава присуство два угљеникова атома у молекулу.[1][2][3]
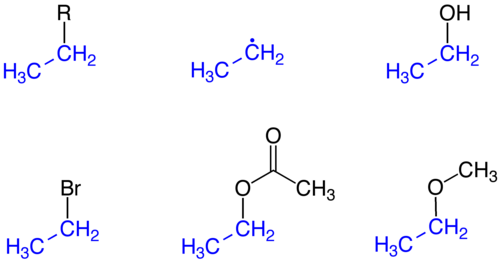
Етилација
уредиЕтилација је формирање једињења увођењем етил групе. Најшире практиковани пример ове реакције је етилација бензена. Етлирајући агенс је етилен.
Процењује се да га је у 1999. произведено преиближно 24,7 милиона тона.[4] Етилбензен је један од прекурзора стирена, који је затим прекурзор полистирена.
Многа једињења која садрже етил групу настају електрофилном етилацијом, тј. третманом нуклеофила изворима Et+. Такав агенс је триетилоксониум-тетрафлуороборат [Et3O]BF4. Код доброг нуклеофила, укључено је мање електрофилнних реагенаса, као што су етил-халиди.
Стереохемија
уредиУ несиметричним метилним једињењима, метиленски протони у етил супституенту су диастеротопни. Хирални реагенси су познати по стереоселективном модификовању таквих супституената.
Етимологија
уредиНазив групе је изведен из имена Етар, прворођенца грчког елементарног Бога ваздуха (у то време општи појам за било врло испарљиво једињење) и hile, позивајући се на „ствари”. Име „етилни” је у 1835. сковао шведски хемичар Јонс Јаков Берцелијус. Године 1834, немачки хемичар Јустус фон Либиг је тврдио је да група C2H5 представља „радикал” (групу атома која се не подвргава променама током хемијске реакције). У приказу Либигових налаза, а у односу и на остале сродне, Берцелијус је сковао имена „метил” и „етил”, за „радикале” CH3 и C2H5.[5][6][7]
Vidi još
уредиReference
уреди- ^ Voet, D.; Voet J. (1995). Biochemistry (2nd изд.). Wiley. Архивирано из оригинала 27. 03. 2020. г. Приступљено 26. 02. 2018.
- ^ Atkins P.; de Paula J. (2006). Physical chemistry, 8th Ed. San Francisco: W. H. Freeman. ISBN 978-0-7167-8759-4.
- ^ Whitten K.W.; Gailey, D. K..; Davis, E. R.. (1992). General chemistry, 4th Ed. Philadelphia: Saunders College Publishing. ISBN 978-0-03-072373-5.
- ^ Vincent A. Welch, Kevin J. Fallon, Heinz-Peter Gelbke "Ethylbenzene" Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. . doi:10.1002/14356007.a10_035.pub2. Недостаје или је празан параметар
|title=(помоћ) - ^ Jacob Berzelius, Årsberättelsen om framsteg i fysik och kemi [Annual report on progress in physics and chemistry] (Stockholm, Sweden: P.A. Norstedt & Söner, 1835)
- ^ Jöns Jacob Berzelius. Årsberättelse om framstegen i fysik och kemi. стр. 376.
- ^ Jöns-Jakob Freiherr von Berzelius. Jahres-Bericht über die Fortschritte der physischen Wissenschaften. 15. стр. 381.
Literatura
уреди- Jöns Jacob Berzelius. Årsberättelse om framstegen i fysik och kemi. стр. 376.
- Whitten K.W.; Gailey, D. K..; Davis, E. R.. (1992). General chemistry, 4th Ed. Philadelphia: Saunders College Publishing. ISBN 978-0-03-072373-5.
- Atkins P.; de Paula J. (2006). Physical chemistry, 8th Ed. San Francisco: W. H. Freeman. ISBN 978-0-7167-8759-4.
- Voet, D.; Voet J. (1995). Biochemistry (2nd изд.). Wiley. Архивирано из оригинала 27. 03. 2020. г. Приступљено 26. 02. 2018.