Арсенитна киселина
Арсенитна киселина је неорганско једињење са формулом H3AsO3. Она је јавља у воденим растворима. Она није била издвојена као чист материјал.[3]
| |
| |
| Називи | |
|---|---|
| IUPAC назив
Arsenitna kiselina
| |
| Други називи
Арсенитна киселина
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| |
| Својства | |
| H3AsO3 | |
| Моларна маса | 125,94 g/mol |
| Агрегатно стање | Постоји само у воденом раствору |
| Опасности | |
| Опасност у току рада | Токсична, корозивна |
| Сродна једињења | |
Сродна једињења
|
Арсенатна киселина |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Особине
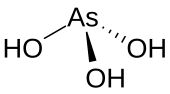
уредиAs(OH)3 је пирамидални молекул који садржи три хидроксилне групе везане за арсен. 1H НМР спектар раствора арсенитне киселине потврђује симетрију молекула.[4] У контрасту с тим, сродна фосфорна киселина H3PO3 углавном поприма структуру HPO(OH)2. P(OH)3 је мање заступљена компонента раствора. Различито понашање једињења As и P одражава тренд да су виша оксидациона стања стабилнија за код лакших елемената групе.[5]
Реакције
уредиПрипрема As(OH)3 се одвија путем споре хидролизе арсен триоксида у води. Додатак базе конвертује арсенитну киселину у арсенитне јоне [AsO(OH)2]-, [AsO2(OH)]2-, и [AsO3]3-. Прва pKa вредност је 9.2. Реакције воденог арсеник триоксида су последица присуства арсенитне киселине и њених коњугованих база.
Токсикологија
уредиЈедињења арсеника су високо токсична и канцерогена. Анхидридна форма арсенитне киселине, арсеник триоксид, се користи као хербицид и пестицид.
Референце
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Еван Е. Болтон; Yанли Wанг; Паул А. Тхиессен; Степхен Х. Брyант (2008). „Цхаптер 12 ПубЦхем: Интегратед Платформ оф Смалл Молецулес анд Биологицал Ацтивитиес”. Аннуал Репортс ин Цомпутатионал Цхемистрy. 4: 217—241. дои:10.1016/С1574-1400(08)00012-1.
- ^ Кинг, Р. Бруце "(ед.)" (1994). Енцyцлопедиа оф Инорганиц Цхемистрy. Цхицхестер: Јохн Wилеy & Сонс.
- ^ Андрáс Колозси; Андреа Лакатос; Гáбор Галбáцс; Андерс Øстергаард Мадсен; Ерик Ларсен & Бéла Гyурцсик (2008). „А пХ-Метриц, УВ, НМР, анд X-раy Црyсталлограпхиц Студy он Арсеноус Ацид Реацтинг wитх Дитхиоерyтхритол” (ПДФ). Инорг. Цхем. 47: 3832—3840. Архивирано из оригинала (ПДФ) 25. 04. 2012. г. Приступљено 18. 12. 2011.
- ^ Греенwоод, Н.Н.; А. Еарнсхаw (1997). Цхемистрy оф тхе Елементс. Оxфорд: Буттерwортх-Хеинеманн.
Спољашње везе
уреди- Токсичност арсеника Архивирано на сајту Wayback Machine (20. новембар 2016)