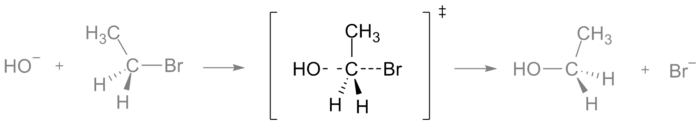Prelazno stanje
Prelazno stanje ili tranziciono stanje hemijske reakcije je specifična konfiguracija duž reakcione koordinate. Ono se definiše kao stanje koji korespondira najvišoj potencijalnoj energiji duž date reakcione koordinate. U toj tački, podrazumevajući perfektno ireverzibilnu reakciju, kolizije molekula reaktanta uvek dovode do formiranja produkta.[1] Ono se obično obeležava simbolom ‡.
Kao primer, ispod je prikazano prelazno stanje koje se javlja tokom SN2 reakcije bromoetana sa hidroksilnim anjonom:

Aktivirani kompleks reakcije se može odnositi na bilo prelazno stanje ili na druga stanja duž reakcione koordinate između reaktanata i produkata, posebno u blizini prelaznog stanja.[3]
Istorija koncepta
уредиKoncept prelaznog stanja je važan u mnogim teorijama o brzini hemijskih reakcija. Ovo je započeto sa teorijom tranzicionog stanja (poznatom kao i teorija aktiviranog kompleksa), koju su razvili Iring, Evans i Polanji oko 1935. godine, i time uveli osnovne koncepte hemijske kinetike koji su i dan danas u upotrebi.
Objašnjenje
уредиSudari između reagujućih molekula mogu in ne moraju da dovedu do uspešne reakcije. Ishod zavis od faktora kao što su relativna kinetička energija, relativna orijentacija i unutrašnja energija molekula. Čak i ako kolizioni partneri formiraju aktivirani kompleks, oni ne moraju da formiraju produkte, i umesto toga kompleks se može raspasti nazad u reaktante.
Posmatranje prelaznih stanja
уредиZbog pravila kvantne mehanike, prelazno stanje se ne može snimiti ili direktno posmatrati; populacija u toj tački je nula. Drugim rečima prijelazno stanje ima kratkotrajno postojanje. Međutim, spretno manipulisane spektroskopske tehnike mogu da nas približe tom stanju u okviru vremenskoj skali date tehnike. Femtohemijska IR spektroskopija je razvijena iz precizno ovog razloga, i moguće je ispitati molekularnu strukturu veoma blizu prelazne tačke. Često duž reakcione koordinate reaktivni intermedijari nisu prisutni na mnogo nižim energetskom sadržaju od nivoa prelaznog stanja, te je teško da se napravi razlika između njih.
Determinacija geometrije prelaznog stanja
уредиStrukture prelaznog stanja se mogu odrediti tražeći tačku sedla prvog reda na površini potencijalne energije (PES) date hemijske vrste.[4] Tačka sedla prvog reda je kritična tačka indeksa jedan, drugim rečima, pozicija na PES koja korespondira minimumu u svim pravcima izuzev jednog. To je detaljnije opisano u članku geometrijska optimizacija.
Hamond–Leflerov postulat
уредиHamond–Leflerov postulat nalaže da struktura prelaznog stanja bliže podseća na bilo produkte ili na početni materijal, u zavisnosti od toga koja strana ima višu entalpiju. Prelazno stanje koje podseća na reaktante više nego na produkte se naziva ranim, dok se prelazno stanje koje više podseća na produkte nego reaktante naziva kasnim. Stoga, Hamond–Leflerov postulat predviđa kasno prelazno stanje za endotermnu reakciju, i rano prelazno stanje za egzotermnu reakciju.
Bezdimenziona reakciona koordinata koja kvantifikuje kasnost prelaznog stanja se može koristiti za testiranje validnosti Hamond–Leflerovog postulata za datu reakciju.[5]
Strukturno-korelacioni princip
уредиStrukturno-korelacioni princip navodi da se strukturne promene koje se javljaju duž reakcione koordinate mogu uočiti u osnovnom stanju u vidu devijacija dužina veza i veličine uglova od normalnih vrednosti duž reakcione koordinate.[6] Prema ovoj teoriji ako se jedna specifična dužina veze pri približavanju prelaznom stanju povećava onda je ta veza već duža u svom osnovnom stanju u poređenju sa jedinjenjem koje nema to prelazno stanje. Jedna demonstracija ovog principa se može naći u dva biciklična jedinjenja prikazana ispod.[7] Jedinjenje na levoj strani je biciklo[2.2.2]okten, koje, na 200°C, istiskuje etilen u retro-Dils-Alderovoj reakciji.
U poređenju sa jedinjenjem na desnoj strani (koje usled nedostatka alkenske grupe ne može da učestvuje u ovoj reakciji) premoštena ugljenik-ugljenik veza se očekuje da bude kraća ako teorija važi, pošto pri prilazu prelaznom stanju ova veza zadobija dvostruki karakter. Za ova dva jedinjenja predviđanje važi sudeći po poređenju kristalnih struktura.
Implikacije za enzimatsku katalizu
уредиJedan način odvijanja enzimatske katalize je putem stabilizovanja prelaznog stanja putem elektrostatike. Snižavanjem energije prelaznog stanja omogućava se većoj populaciji početnog materijala da dosegne energetski nivo koji je neophodan za prevazilaženje tranzicione energije i za formiranje produkta.
Vidi još
уреди- Teorija prelaznog stanja
- Analozi prelaznog stanja, hemijska jedinjenja koja oponošaju prelazno stanje supstrata i deluju kao enzimski inhibitori
Reference
уреди- ^ Solomons, T.W. Graham & Fryhle, Craig B. (2004). Organic Chemistry (8th изд.). John Wiley & Sons, Inc. ISBN 0-471-41799-8.
- ^ The calculation used a B3LYP functional and a 6-31+G* basis set.
- ^ Peter Atkins and Julio de Paula, Physical Chemistry (8th ed., W.H. Freeman 2006), p.809 ISBN 0-7167-8759-8
- ^ Frank Jensen (1999). Introduction to Computational Chemistry. England: John Wiley and Sons Ltd.
- ^ Thomas A. Manz; David S. Sholl (2009). „A dimensionless reaction coordinate for quantifying the lateness of transition states”. J. Comput. Chem.: NA. doi:10.1002/jcc.21440.
- ^ Buergi, Hans Beat; Dunitz, Jack D. (1983). „From crystal statics to chemical dynamics”. Accounts of Chemical Research. 16 (5): 153. doi:10.1021/ar00089a002.
- ^ Goh, Yit Wooi; Danczak, Stephen M.; Lim, Tang Kuan; White, Jonathan M. (2007). „Manifestations of the Alder−Rickert Reaction in the Structures of Bicyclo[2.2.2]octadiene and Bicyclo[2.2.2]octene Derivatives”. The Journal of Organic Chemistry. 72 (8): 2929—35. PMID 17371072. doi:10.1021/jo0625610.