Genska terapija
Genska terapija je savremen pristup u lečenju ili prevenciji različitih bolesti zasnovan na uvođenju „divljeg” tipa (eng.wild type) gena (genskog materijala) u ćelije zahvaćene mutacijom. Prema načinu unosa genskog materijala, vektorom ili direktnimnim ubacivanjem ogoljene DNK, razlikujemo somatsku gensku terapiju (jetre, mozga, mišića, kože, bubrega) i germinativnu (kod koje se genski materijal unosi u polne ćelije, s tim što promene uzrokovane manipulacijom na reproduktivnim ćelijama neće biti prenesene sledećim naraštajima). U okviru ovog postupka postoji i terapija in vivo kod koje se genski materijal unosi direktno u bolesnika, zatim in vitro, ex vivo adicija ili zamena gena kod ljudi ili na animalnim modelima[1] Osnovni preduslov za gensku terapiju je ovladavanje metodologijom dobijanja izdvojenog gena, koji će se ubacivati u genom. Sekvencioniranje i kloniranje humanih gena poznato je još od 1980. godine, kada je humani gen za proizvodnju insulina (deficijentan kod šećerne bolesti tip 1) ubačen u genom bakterije, koja je počela da proizvodi humani insulin. Ovako dobijeni insulin i danas se koristi u terapiji šećerne bolesti.
U narednim decenijama očekuje se da će se nakon uspešne izolacije gena u kojima su ispoljeni monogenetski poremećaji genskom terapijaom, i po prvi put dobije lek za genetičke bolesti, ili da se uvođenjem DNK i oligonukleotida u ćelije omogući lečenje nenaslednih bolesti, kao što je npr. karcinom.
Međutim genska terapija je još uvek u početnoj fazi istraživanja i razvoja, i može se smatrati eksperimentalnom metodom, sa velikim brojem kliničkih proba. Uspeh genske terapije na svim poljima bio bi, svakako najveće i najvažnije otkriće 21. veka. Teorijske mogućnosti genske terapije su izvanredne, praktična primena pokazuje rezultate, ali to je svakako nedovoljno da zadovolji brojna velika očekivanja, koja u budućnost moraju biti realizovana, pre svega zbog nas i naših potomaka.
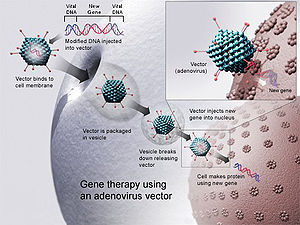
Istorija
уредиKao datum kada je prvi put počela da se primjenjuje genska terapija uzima se 14. septembar 1990. godine, kada je četvorogodišnja devojčica, rođena sa teškom i kombinovanom imunodeficijencijom (retkim urođenim oboljenjem u kome nedostaje gen za enzim adenozindeaminazu neophodan za normalan imunski odgovor, pa je organizam osetljiv na svaki patogen), dobila gensku terapiju.[2] Kod ove devojčice je genska terapija izvedena tako što su prvo uzeti leukociti iz periferne krvi, zatim su kolonizirani u laboratoriji, pa je u tu kulturu leukocita ubačen gen koji nedostaje. Leukociti su nakon toga vraćeni u krv. Genska terapija je kod ove devojčice poboljšala imuni odgovor, ali nije dovela do konačnog izlečenja, zato što genetski tretirani leukociti žive samo nekoliko meseci, pa to zahteva da se terapija ponavlja.[3]
Procenti sadašnjih ispitivanja genske terapije
уредиOpšta razmatranja
уредиGenska terapija, koja je za sada eksperimentalna tehnika, korisiti gene da leči i sprečava nastanak nekih bolesti! Ona obuhvata niz in vivo, ex vivo i in vitro metode i postupake za prekomponovanje postojećih i unošenje funkcionalnih kopija gena, koji zamenjuju ili nadopunjuju (ne)aktivnost alelnih varijanti koje su odgovorne za mnoge bolesti.[4]
U budućnosti ova će tehnika dovesti do toga da lekari mogu da leče bolesti ubacujući gene u bolesnikove ćelije umesto primene lekova i operacija!
Istrazivači su do sada, testirali nekoliko pristupa genskoj terapiji, uključujući:[4]
- Zamenjivanje mutiranih gena (tehnikom homologe rekombinacije) koji uzrokuju bolesti sa njihovim zdravim kopijama.
- Inaktiviranje (eng. „knocking out”) mutiranih gena koji ne funkcionisu nepravilno.
- Ubacivanje novih gena u organizam u genom na nespecifičnu lokaciju u cilju borbe protiv bolesti (ovo je najčešdi način).
- Popravljanje mutiranog gena tehnikom selektivne reverzne mutacije (tako da je gen osposobljen za normalnu funkciju)
- Supresiju aktivnosti oštečenog gena novim genom
Opštepoznati termini kao što su: genetički inženjering, genska manipulacija, gensko kloniranje, tehnologija rekombinantne DNK, DNK kloniranje, genetička modifikacija, molekulsko kloniranje, pa i „nova genetika”, opisuju istoznačne pojmove u oblasti biotehnologije na bazi genetičkog inženjerstva. Svi se odnose na istovetan proces: svrsishodni transfer ciljanih fragmenata i molekula DNK iz jednog organizma u samoreplicirajuće genetičke strukture drugog, ili transgenozu. Takvi transgeni fragmenti DNK se kasnije mogu, u potrebnoj količini kopija, propagirati u „stranoj ćeliji domaćinu”.[5]
Pored genetskog inženjerstva na molekularnom nivou već su odavno u primeni i manipulacije većim kompleksima genetičkog materijala – hromozomima i kompletnim genomima (označene kao hromozomsko i genomsko inženjerstvo).[6][7][8]
Oblici genske terapije
уреди- Germinativna genska terapija
Cilj zahvata u polnih ćelijama je korekcija poremećene funkcije određenog gena koja uzrokuje neke teške bolesti. Jedna mogućnost ovog lečenja je unos gena u polne ćelije čime bi se poremećaj koriguje u svim ćelijama potomaka.
Prema tome, jasno je da genska manipulacija polnim ćelijama može imati neizbrisive posledice za razvoj budućeg organizma. Tako se npr. U terapiji zametnim nizom genetičke se promene se vrše u spermi, jajašcima ili ćelijama embrionalnom i prenose na buduće generacije. Ova terapija dovodi do suženja zalihe ljudskih gena na koju računaju buduće generacije.
Ovakav vid terapije je nov i potrebno je ispitati njene posledice pre bilo kakvih pokušaja, pa je zbog toga i zabranjena u većini zemalja. Ipak, 2001. godine naučnici su potvrdili rođenje 30 ,,genetski modifikovanih beba’’, čije su majke bile podvrgnute ovoj proceduri.
- Somatska genska terapija
Ova vrsta genetičke terapije koju su 1990. godine prvi put primenili French Anderson i grupa naučnika iz Nacionalnog zavoda za zdravlje.[9] zasniva se na intervenciji koja se vrši samo u somatskim ćelijama (telesnim ćelijama, isključujući polne ćelije) nakon koje genetičke promene ne prelaze na potomstvo.
Somatska terapija može povećati broj preživelih osoba sa defektnim genima u njihovim zametnim nizovima – genima i na taj će se način može se prenositi sve veći broj genetskih problema na sledeće generacije.
Budući da današnji prenatalni genetički testovi mogu otkriti da li je fetus ili embrion zahvaćen nekim poremećajem, roditeljima preostaje odluka o pobačaju oštećenog ploda.
Zabrinjavajuća je metoda ovakvih postupaka, osim otkrivanja nepravilnosti na genu, odabir pola deteta. Postupak se sprovodi posmatranjem amnionske tečnosti, a prvi uspešni slučaj sproveden je 1955. godine. Široka primena ovih postupaka sedamdesetih je godina postala je rutina. Osim odabira pola deteta koji je danas najzastupljeniji u azijskim zemljama, naročito Kini, u kojoj se odabiranju najvećim delom muška deca, ovakve metode mogu popraviti kozmetičke poremećaje u jajašcu, spermi i embrionalnom ćelijama budućeg deteta.
- In vivo genska terapija
Kod obe terapije transgen se direktno uvodi u ćelije napadnute zarazom. Na ovaj način moguće je lečiti cističnu fibrozu ili mišićnu ditrofiju. Tako bi DMD bila tretirana uvođenjem distrofin gena u mišićne ćelije, a CF uvođenjem CFTR gena u ćelije vazdušnog protoka. Kod obe bolesti su to ćelije čija poremećena funkcija izaziva glavne efekte koji su opasni po život, međutim nisu jedine.
Bolesnici sa cističnom fibrozom mogu da pate od pankreasnog nedostatka, defekta u vas deferensu, problema jetre, dok bolesnici s mišićnom distrofijom imaju problema sa srcem ili defekte CNS-a.
Kada bi i ovi defekti bili uspešno otklonjeni ne znači da bi bolest u potpunosti bila izlečena .
- Ex vivo genska terapija
Vrši se uvođenjem transgena u izolovane ćelije, da bi se njima moglo manipulisati in vitro. Zatim se vrši selekcija onih ćelija koje su primile transgen, pa se ovi ćelijski klonovi ponovo uvode u telo pacijenta.
Ovaj oblik terapije je pogodan za genetičke defekte koji se odnose na krvne ćelije. Korišćen je u lečenju dificijencije adenozin deaminaze (ADA) i to je jedina genska terapija koja je do sada dala rezultate kliničkog poboljšanja.
- Adicija ili zamena gena
U ovom tretmanu defektni gen se u potpunosti zamenjuje funkcionalnim transgenom, što bi obezbedilo terapiju za sve tipove mutacija. Zamena bi uključivala homologu rekombinaciju između transgena i hromozomalne kopije, što je moguće, jer se genetičari oslanjaju na ovakvu rekombinaciju.
Zamena gena zahteva procedure u kojima se bira mali broj ćelija kojima je promena potrebna. ,,Germline’’ terapija zahteva precizne zamene gena , jer je to jedini siguran način da se obezbedi kompletno normalna ekspresija gena. Smatra se da je zato ova terapija još uvek nemoguća, što svakako dovodi u pitanje gore navedene podatke o rođenju ,,prvih genetski modifikovanih beba’’. Iz dostupne literaturu može sa saznati da su se uglavnom vodile rasprave o tome da li je to moguće ili ne, ali nema čvrstih dokaza koji bi nas mogli ubedili da je ovaj tip genske terapije uspešano primenjen, iako je sama procedura opisana i teoretski svakako moguća.
- Animalni modeli
Kako genske terapije zahtevaju niz eksperimenata , ne mogu se svi izvoditi na ljudima, pa su animalni modeli korisni za demonstraciju principa i razvoja tehnologije. Kako npr. transgeni miševi pate od sličnih simptoma kao i ljudi, oni mogu da budu animalni modeli u cilju razvoja genske terapije.
Rezultati
уредиGenske terapije koje su do sada testirane odnosile su se na ćelije koštane srži i krvne ćelije.
Uvođenjem novog gena u spermatozoid ili jajnu ćeliju novi gen može da se prenese na potomstvo, što bi predstavljalo germlinu gensku terapiju. Ova vrsta terapije nije naišla na odobravanje, jer se smatra da, iako bi pomogla u spečavanju nastanka određenog genskog poremećaja u pojedinim porodicama, nije izvesno kakav efekat bi novi gen mogao da ima na razvijanje fetusa i da li bi mogao dati neke kasne neželjene posledice.
S obzirom na to da osobe koje bi bile obuhvačene germlajn genskom terapijom još nisu rođene, one ne mogu same da odluče da li žele ili ne žele ovakvu terapiju, tako da ova istraživanja na ljudima nisu dozvoljena.
Vektori
уредиImajući u vidu da gen koji je direktno ubačen u citoplazmu ćelije uglavnom ne ostvaruje svoju funkciju.[10] Da bi funkcija bila ispunjena, potrebno je gen na neki drugi način ubaciti u ćeliju. Za ovo postoji nekoliko metoda:[11]
- Korišćenjem virusnih vektora, odnosno genetski izmjenjenih virusa (koji ne mogu da izazovu bolest, već samo ga uvegu gen u genom inficirane ćelije).[12]
- Korišćenjem nevirusnih vektora, uglavnom u formi lipozoma (lipidnih sfera), koji mogu da prenesu DNK kroz membranu ćelije domadina (biohemijski kompleks DNK u lipozomu naziva se lipokompleks)
- Hemijskim povezivanjem molekula DNK sa molekulom koji može da se veže sa određenim ćelijskim receptorima, nakon čega DNK prolazi kroz membranu i ulazi u ćeliju (ovaj metod je manje efikasan od drugih navedenih metoda).[10]
Vektori se u organizam čoveka ubaciju na tri načina:[13]
- intravenski,
- direktnim ubrizgavanjem u specifično tkivo, gde ih preuzimaju individualne ćelije tog organa
- izlaganjem uzorak ćelja pacijenta delovanju vektora, u laboratoriji, a zatim se te ćelije vraćaju u organizam pacijenta.
Ukoliko je tretman uspešan, novi gen će početi da kodira funkcionalan protein.
Najnoviji metod ubacivanja novih gena u ćelije domaćina je stvaranje novog, veštačko g 47. hromozoma, koji bi egzistirao autonomno, pored već postojećih 46 hromozoma domaćina. Za ovaj metod unošenja terapijskog gena potreban je veoma veliki vektor. Veruje se da zbog konstrukcije i autonomije veštačkog hromozoma, imuni sistem neče napadati taj hromozom.
Virusni vektori
уредиVektori su nosači koji se koriste prilikom ubacivanja genskog materijala u ćeliju. Najčešće se za tu svrhu koriste virusni vektori (retrovirusi, adenovirusi, AAV, HIV itd.). Virusi su pogodni kao vektori jer su tokom milijardi godina evolucije stekli i usavršavali aparat pomoću kojeg se mogu ubaciti u živu ćeliju, integrirati svoj genetski materijal u genom ćelije, i time navesti molekularni aparat ćelije da prepisuje njihove gene.[12]
Međutim ovakav pristup nije bez opasnosti, jer imunološki sistem bolesnika može reagovati na unošenje virusa, i virus potpuno eliminisati, ponekad uz potencijalno smrtonosnu imunološku reakciju.
| Vektor | Veličina transgena | Integracija | Transdukciona efikasnost | Glavne prednosti | Glavni nedostaci |
|---|---|---|---|---|---|
| MMLV | <8kB | Da | Visoka | Stabilna transfekcija ćelija u deobi | Inficira samo ćelije koje se brzo dele |
| Adeno | <7.5kB | Ne | Visoka | Transfecira ćelije u deobi i van nje, tropizam ka respiratornom tkivu | Prolazna ekspresija, izaziva imuni odgovor, uobičajen humani virus |
| AAV | <4kB | Da (?) | Visoka | Stabilna transfekcija | Mala veličina transgena, integracija slabo razumljiva |
| HSV | <20kB | Ne | Niska | Velika veličina transgena, neurotropan. | Prolazna ekspresija, moguće generisanje infekcije sa HSV |
| Vaccinia | <25kB | Ne | Visoka | Efikasna infekcija ćelija | Limitirana primena kod vakcinisanih ili imunokompromitovanih individua |
Nevirusni vektori
уредиU ovu veliku grupu spadaju različite čestice koje na osnovu svojih fizičko-kemijskih svojstava mogu u ćeliju uneti, sa sobom „upakovanu” DNA, ali je ne mogu uklopiti u ćelijski genom, što ih čini izrazito neefikasnima u poređenju sa virusnim vektorima. Primer iz ove grupe su lipozomi, asijaloglikoprotein(ASGP)[14] itd.
U laboratorijskim uslovima, DNA se u ćeliju može ubacivati i pomoću električne struje, mikroiniciranjem, ispaljivanjem koloidnih čestica (gene-guna) itd. Nažalost, što je veća efikasnost unošenja gena nevirusnim metodama, veće je i oštećenje i smrtnost ćelija.
Rizici genske terapije
уредиUz sve prednosti genske terapije, postoje i brojni (stvarni ili hipotetski) rizici aplikacije navedenih biotehnologija.[8]
Mnogi eksperti upozoravaju i na mogućnost inkorporiranja ebola ili MSC virusa ("bolesti ludih krava") u ljudski genom i pojave odgovarajućih i drugih pandemija. Istovremeno, u jednoj od prihvatljivijih hipoteza, naučnici vjeruju da je HIV u genom ljudske vrste inkorporiran konzumacijom majmunskog mesa. Argumentacija da je takva opasnost izbjegnuta u slučaju Ishrane svinjskim mesom i njegovim prerađevinama traži se u činjenici da je ono u ljudski jelovnik uključeno još prije 10–12 milenijuma (u bliskoistočnoj i kineskoj regiji domestikacije), a bez registrovanih masovnih i ozbiljnijih infekcija takve prirode.[8]
Problemi u genskoj terapiji
уреди| I pored izvesnih promašaja u genetskoj terapiji, što je dovelo do sumnje i zabrinutosti u široj populaciji, njen razvoj je realnost, kao i činjenica da ona ima svoje mesto u medicini.
Važno je istaći da genetskoj terapiji treba pristupati sa izuzetno visokim stepenom naučne, stručne i etičke odgovornosti, jer se mora isključiti mogućnost genetskih manipulacija opasnih za ljudsko zdravlje. |
Izuzetno visok stepen naučne, stručne i etičke odgovornosti zahteva od terapeuta da u terapiji stalno ima u vidu i isključi mogućnost genetskih manipulacija, zbog: tehničkih nedostataka, nedovoljnog poznavanja načina prenošenja gena, brojčanosti gena, uticaja okoline, nerazumevanja funkcije gene itd.
Tehnički nedostaci
уредиNajveći problemi genske terapije su tehnički nedostaci, jer ne postoji siguran način da se novi geni ubace u tačno određene ćelije i da se njihova funkcija posle insercije precizno kontroliše. Ovo predstavlja ozbiljan rizik po zdravlje, naročito zbog potencijalne toksičnosti, inflamacije i kancerogeneze. Patofiziološki supstrat karcenogeneze posle primene genske terapije je insercija novog gena na pogrešno mesto u genomu, i to u tumor supresorske gene.
Način prenošenja gena
уредиNačin prenošenja gena iako je jedan od problema, on se prevazilazi vektorima i to virusima, a alternativa njima je kompleks DNK sa lipidima i proteinima (inseriranjem 47-og hromozoma — veštačkog ljudskog) u telo. Ovaj vektor bi automatski funkcionisao pored standardnih 46 hromozoma – ne utičući na njihov rad i ne izazivajući mutacije. To bi bio ogroman vektor sposoban da brine o genetičkom kodu i da ga odredi, na osnovu konstrukcije, a imuni sistem ga ne bi napadao stvarajući negativan odgovor na opisane viruse.
Višegenska oboljenja
уредиVećina genetičkih bolesti zahvata više od jednog gena, a na njih utiče i okolina. Proučavanja koja su vršena na identičnim blizancima pokazuju da oni ne boluju od istih bolesti, što govori o uticaju okoline na razvoj individua.
Nerazumevanje funkcije gena
уредиDo sada je otkriveno 100.000 gena, ali je funcija najvećeg broja još uvek nepoznata. Pokušavajući gensku terapiju, a ne znajući kako ceo sistem funkcioniše može da se odredi funkcija gena samo za pojedine bolesti (npr srpasta anemija je oboljenje izazvano greškom na genu koji telu govori kako se sintetiše hemoglobin). Greška u genima koja se javlja postoji već hiljadama godina među ljudima. Kada se jednom sekvenca ljudskog genoma kompletira, sledeći korak će biti određivanje funkcije svakog gena ponaosob.
Etička pitanja
уредиPored svih navedenih problema postoje i etička pitanja u vezi sa primenom genske terapije:[15]
- Koja je granica između dozvoljene upotrebe i zloupotrebe genske terapije?
- Ko je nadležan da odluči koji su fenotipski oblici patološki, a koji normalni?
- Da li je genska terapija zbog svoje visoke cene dostupna isključivo dobrostoječim grupama?
- Da li će masovnija upotreba genske terapije dovesti do toga da su različite osobe društveno manje prihvatljive?
- Da li treba dozvoliti ljudima da genskom terapijom poboljšaju osnovne ljudske osobine, kao što su visina, inteligencija, atletske sposobnosti itd?
Izvori
уреди- ^ Krešimir Pavelić, čuda moderne medicine, Nakladni zavod Globus, Zagreb, 2004.
- ^ Blaese, R. M.; Culver, K. W.; Chang, L.; Anderson, W. F.; Mullen, C.; Nienhuis, A.; Carter, C.; Dunbar, C.; Leitman, S.; Berger, M. (1993). „Treatment of severe combined immunodeficiency disease (SCID) due to adenosine deaminase deficiency with CD34+ selected autologous peripheral blood cells transduced with a human ADA gene. Amendment to clinical research project, Project 90-C-195, January 10, 1992”. Human Gene Therapy. 4 (4): 521—7. PMID 7691188. doi:10.1089/hum.1993.4.4-521.
- ^ Bordignon C, Mavilio F, Ferrari G, Servida P, Ugazio AG, Notarangelo LD, Gilboa E, RossiniS, O'Reilly RJ, Smith CA. „Transfer of the ADA gene into bone marrow cells andperipheral blood lymphocytes for the treatment of patients affected by ADA-deficientSCID.”. Human Gene Therapy. 4 (4): 513—20. 1993..
- ^ а б „A handbook of gene and cell therapy | WorldCat.org”. www.worldcat.org (на језику: енглески). Приступљено 2023-02-14.
- ^ Capecchi MR (октобар (2001). „„Generating mice with targeted mutations”.”. Nature Medicine. 7 (10): 1086—90..
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 978-9958-9344-1-4.
- ^ Kapur Pojskić L., Ed. (2014): Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 978-9958-9344-8-3.
- ^ а б в Hadžiselimović R., Pojskić N. (2005): Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. ISBN 978-9958-9344-3-8.
- ^ J. Rifkin, Biotehnološko stoljeće, trgovina genima u osvrt vrlog novog svijeta, Jesenski i Turk – Hrvatsko sociološko društvo, Zagreb, 1999, str. 165.
- ^ а б Roman G, Pálffy R, Hodosy J, Lukács J, Turňa J, Celec P (2005). „Vectors and delivery systems in gene therapy.”. Medical Science Monitor. 11 (4): 110—21..
- ^ Salmons, B.; Gunzburg, W. H. (1993). „Targeting of retroviral vectors for gene therapy.”. Human Gene Therapy. 4 (2): 129—41..
- ^ а б Gerard, R D, Collen D (1997). „Adenovirus gene therapy for hypercholesterolemia, thrombosis and restenosis.”. Cardiovascular Research. 35: 451—8..
- ^ Human gene therapy. (на језику: енглески). DIANE Publishing. ISBN 978-1-4289-2371-3.
- ^ R. J. Stockert (1. 7. 1995). The asialoglycoprotein receptor: relationships between structure, function, and expression. Physiol Rev. 75: 591—609.
- ^ Kimmelman J. (2005). „Recent Developments in Gene Transfer: Risk and Ethics”. BMJ. 7482 (330): 79—82.
Literatura
уреди- Flint S. J. et al., Principles of Virology: Molecular biology, pathogenesis, and control. . ASM Press. 2000..
- Viral vetors, urednici Angel Cid-Arregui i Alejandro Garcia-Carranca. . Eton Publishing/BioTechniques Books. 2000..
- Nonviral vectors for gene therapy, urednici Leaf Huang, Mien-Chie Hung i Ernst Wagner. . Academic Press. 1999..
- Vector targeting for therapeutic gene delivery, urednici David T Curiel i Joanne T Douglas, John Willey & Sons, Inc., 2002.
- Donald De Marco – Benjamin Wiker, arhitekti kulture smrti, Verbum, Split, 2007.
- Darko Polšek, Sudbina odabranih, ArTresor naklada, Zagreb, 2004. Zbornik radova Izazovi bioetike, urednik Ante Čović, Pergamena, Zagreb, 2000.
Spoljašnje veze
уреди- Genska terapija Архивирано на сајту Wayback Machine (25. фебруар 2018)
- Commercial gene therapies produced by 2020 (језик: енглески)
| Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |