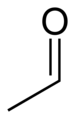
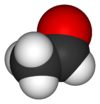
Acetaldehid
Acetaldehid (etanal) je organsko hemijsko jedinjenje sa formulom CH3 CHO. Pojedini izvori ga obeležavaju sa MeCHO (Me = metil). On je jedan od važnijih aldehida, koji je široko zastupljen u prirodi. On se industrijski proizvodi u velikim količinama. Acetaldehid se u prirodi javlja u kafi, hlebu i zrelom voću. Biljke ga proizvode kao deo normalnog metabolizma. On se takođe proizvodi putem oksidacije etilena i smatra se da je uzrok mamurluka nakon alkoholne konzumpcije.[7] On je prisutan u vazduhu, vodi, zemljištu, kao i u piću i dimu.[8]
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
etanal
| |||
| Drugi nazivi
Acet aldehid
etil aldehid[1] | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.761 | ||
| EC broj | 200-836-8 | ||
| KEGG[2] | |||
| RTECS | AB1925000 | ||
| UNII | |||
| |||
| Svojstva | |||
| C2H4O | |||
| Molarna masa | 44,05 g·mol−1 | ||
| Agregatno stanje | Bezbojna tečnost Opor, voćni miris | ||
| Gustina | 0,784 g·cm−3 (20 °C)[5]
0,7904–0,7928 g·cm−3 (10 °C)[5] | ||
| Tačka topljenja | −1.235 °C (−2.191 °F; −962 K) | ||
| Tačka ključanja | 202 °C (396 °F; 475 K) | ||
| rastvoran je u svim proporcijama | |||
| Viskoznost | ~0,215 na 20 °C | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | trigonalno planarni (sp2) na C1 tetraedralni (sp3) na C2 | ||
| Dipolni moment | 2,7 D | ||
| Termohemija | |||
| Standardna molarna entropija S |
250 J·mol−1·K−1 | ||
Std entalpija
formiranja (ΔfH⦵298) |
−166 kJ·mol−1 | ||
| Opasnosti | |||
| GHS grafikoni |    [6] [6]
| ||
| H224, H319, H335, H351[6] | |||
| P210, P261, P281, P305+351+338[6] | |||
EU klasifikacija (DSD)
|
Veoma je zapaljiv (F+) Štetan (Xn) Carc. Cat. 3 | ||
| R-oznake | R12 R36/37 R40 | ||
| S-oznake | (S2) S16 S33 S36/37 | ||
| NFPA 704 | |||
| Tačka paljenja | 234,15 K (−39 °C) | ||
| 185,15 °C (365,27 °F; 458,30 K) | |||
| Srodna jedinjenja | |||
Srodne aldehidne materije
|
Formaldehid Propionaldehid | ||
Srodna jedinjenja
|
Etilen oksid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Produkcija
уредиGlobalna produkcija je bila milion tona 2003.[9] Glavni proizvodni metod je oksidacija etilena:
- 2 CH2=CH2 + O2 → 2 CH3CHO
Alternativno se može koristiti hidracija acetilena, katalizovana solima žive, čime se formira etenol, koji se tautomerizuje do acetaldehida. Ovaj industrijski put je ranije bio dominantan.[10] Kad su potrebne manje količine, acetaldehid se može pripremiti putem dehidrogenacije ili parcijalne oksidacije u kombinaciji sa dehidrogenacijom. Acetaldehid se može formirati hidrogenacijom CO, mada taj metod nema industrijsku primenu.[9]
Reference
уреди- ^ SciFinderScholar (accessed 4 Nov 2009). Acetaldehyde (75-07-0) Substance Detail.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Stoffdaten Acetaldehyd bei Celanese Chemicals. as of December 1999.
- ^ а б в Sigma-Aldrich Co. Retrieved on 20. 07. 2013.
- ^ How Hangovers Work, HowStuffWorks
- ^ Chemicals in the Environment: Acetaldehid (CAS No. 75-07-0)
- ^ а б Eckert, Marc; Fleischmann, Gerald; Jira, Reinhard; Bolt, Hermann M.; Golka, Klaus (2006). „Acetaldehyde”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 9783527303854. doi:10.1002/14356007.a01_031.pub2..
- ^ Dmitry A. Ponomarev and Sergey M. Shevchenko (2007). „Hydration of Acetylene: A 125th Anniversary” (PDF). J. Chem. Ed. 84 (10): 1725. Bibcode:2007JChEd..84.1725P. doi:10.1021/ed084p1725. Архивирано из оригинала (PDF) 11. 06. 2011. г. Приступљено 20. 11. 2012.