Diboran
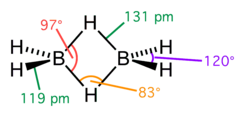
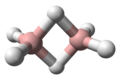
Diboran je hemijsko jedinjenje, koje se sastoji od bora i vodonika sa formulom B2H6.[1] [2] On je bezbojni gas na sobnoj temperaturi sa repulzivno slatkim mirisom. Diboran se dobro meša sa vazduhom, lako formirajući eksplozivne smeše. Diboran se spontano pali u vlažnom vazduhu na sobnoj temperaturi. Sinonimi su boroetan, bor hidrid, i dibor heksahidrid.
| |
| |
| Nazivi | |
|---|---|
| IUPAC naziv
Diboran(6)
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.039.021 |
| EC broj | 242-940-6 |
| RTECS | HQ9275000 |
| |
| Svojstva | |
| B2H6 | |
| Molarna masa | 27,67 g·mol−1 |
| Agregatno stanje | Bezbojni gas |
| Gustina | 1,216 g/dm3 |
| Tačka topljenja | −16.485 °C (−29.641 °F; −16.212 K) |
| Tačka ključanja | −925 °C (−1.633 °F; −652 K) |
| Struktura | |
| Geometrija molekula | Tetraedralna (za bor) |
| Dipolni moment | 0 D |
| Opasnosti | |
| NFPA 704 | |
| 38 °C (100 °F; 311 K) | |
| Srodna jedinjenja | |
Srodne jedinjenja bora
|
Dekaboran BF3 |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Diboran je ključno jedinjenje bora sa mnoštvom primena. Ovo jedinjenje je klasifikovano kao "endotermno", što znači da je njegova toplota formiranja, ΔH°f pozitivna (36 kJ/mol). Uprkos njegove termodinamičke nestabilnosti, diboran je kinetički robustan i manifestuje ekstenzivnu hemiju, većina koje je vezana za gubitak vodonika.
Opšta formula borana
уредиČetiri serije borana sa jednim klasterom imaju sledeće opšte formule, gde je "n" broj atoma bora:
| Tip | Formula | Napomena |
|---|---|---|
| klozo− | BnHn2− | Neutralni BnHn+2 borani nisu poznati |
| nido− | BnHn+4 | |
| arahno− | BnHn+6 | |
| hifo− | BnHn+8 | samo su adukti poznati |
Takoše postoje serije supstituisanih neutralnih hiperklozo-borana koji imaju teoretsku formulu BnHn. Primeri su B12(OCH2Ph)12, koji je stabilni derivat hiperklozo-B12H12.[3]
Reference
уреди- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ Peymann, Toralf; Knobler, Carolyn B.; Khan, Saeed I.; Hawthorne, M. Frederick (2001). „Dodeca(benzyloxy)dodecaborane, B12(OCH2Ph)12: A Stable Derivative of hypercloso-B12H12”. Angew. Chem. Int. Ed. 40 (9): 1664—1667. doi:10.1002/1521-3773(20010504)40:9<1664::AID-ANIE16640>3.0.CO;2-O.
Literatura
уреди- H. C. Brown; H. C. (1975). Organic Synthesis via Boranes. New York: John Wiley. ISBN 978-0-471-11280-8.
