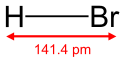
Bromovodonik
Bromovodonik je diatomski molekul HBr. HBr je gas pod standardnim uslovima. Bromovodonična kiselina se formira nakon rastvaranja HBr u vodi. HBr se može osloboditi iz rastvora bromovodonične kiseline dodavanjem dehidracionog agensa, ali ne putem destilacije. Bromovodonik i bromovodonična kiselina, stoga, nisu isto, nego su srodni. Često se bromovodonična kiselina označava sa "HBr".
| |||
| Nazivi | |||
|---|---|---|---|
| Preferisani IUPAC naziv
Vodonik bromid | |||
| Sistemski IUPAC naziv
Broman[1] | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| Bajlštajn | 3587158 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.090 | ||
| EC broj | 233-113-0 | ||
| KEGG[2] | |||
| MeSH | Hydrobromic+Acid | ||
| RTECS | MW3850000 | ||
| UN broj | 1048 | ||
| |||
| Svojstva | |||
| BrH | |||
| Molarna masa | 80,91 g·mol−1 | ||
| Agregatno stanje | Bezbojni gas | ||
| Miris | Oštar | ||
| Gustina | 3,307 g dm-3 | ||
| Tačka topljenja | −87 °C; −125 °F; 186 K | ||
| Tačka ključanja | −66 °C; −87 °F; 207 K | ||
| 1,93 kg dm<sup>-3 (na 20°C) | |||
| Napon pare | 2,308 MPa (na 21°C) | ||
| Kiselost (pKa) | ~–9[5] | ||
| Baznost (pKb) | ~23 | ||
| Indeks refrakcije (nD) | 1,325 | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | Linearan | ||
| Dipolni moment | 82 mD | ||
| Termohemija | |||
| Specifični toplotni kapacitet, C | 350.7 mJ K-1 g-1 | ||
| Standardna molarna entropija S |
198.696-198.704 J K-1 mol-1 | ||
Std entalpija
formiranja (ΔfH⦵298) |
-36.45--36.13 kJ mol-1 | ||
| Opasnosti | |||
| Bezbednost prilikom rukovanja | hazard.com | ||
| GHS grafikoni |  
| ||
| GHS signalna reč | DANGER | ||
| H314, H335 | |||
| P261, P280, P305+351+338, P310 | |||
EU klasifikacija (DSD)
|
|||
| R-oznake | R35, R37 | ||
| S-oznake | (S1/2), S7/9, S26, S45 | ||
| NFPA 704 | |||
| Srodna jedinjenja | |||
Srodna jedinjenja
|
Hlorovodonik | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Osobine
уредиNa sobnoj temperaturi, HBr je nezapaljivi gas oštrog mirisa, koji se dimi na vlažnom vazduhu usled formiranja bromovodonične kiseline. HBr je veoma rastvoran vodi, u kojoj se zasićuje sa 68.85% HBr po težini na sobnoj temperaturi. Vodeni rastvori koji su 47.38% HBr po težini formiraju konstantno ključajuću smesu (reverzno azeotropnu), koja ključa na 126°C. Ključanjem manje koncentrovanih rastvora se otpušta H2O dok se smeša konstantne kompozicije ne formira.
Upotreba
уредиPostoje mnogobrojne upotrebe HBr u hemijskoj sintezi. Na primer, HBr se koristi za produkciju alkil bromida iz alkohola:
- ROH + HBr → RBr + H2O
HBr se dodaje alkenima da bi se dobili bromoalkani, koji su važna familija organobrominskih jedinjenja:
- RCH=CH2 + HBr → RCH(Br)–CH3
Dodavanjem HBr alkinima nastaju bromoalkeni. Stereohemija ovog tipa adicije je obično anti:
- RC≡CH + HBr → RC(Br)=CH2
Dodatak HBr na haloalkene formira geminalne dihaloalkane. (Ovaj tip adicije sledi Markovnikovo pravilo):
- RC(Br)=CH2 + HBr → RC(Br2)–CH3
Takođe, HBr se koristi za otvaranje epoksida i laktona, i u sintezi bromoacetala. Dodatno, HBr katalizuje mnoge organske reakcije.[6][7][8][9]
Predloženo je da se HBr koristi u protočnim baterijama.[10]
Industrijska priprema
уредиBromovodonik (zajedno sa bromovodoničnom kiselinom) se proizvode u mnogo manjim razmerama od odgovarajućih hlorida. U primarnoj industrijskoj pripremi, vodonik i brom se kombinuju na temperaturama između 200-400°C. Ova reakcije je tipično katalizovana platinom ili azbestom.[7][11]
Laboratorijske sinteze
уредиHBr se može sintetisati koristeći niz metoda. On se može pripremiti u laboratoriji destilacijom rastvora natrijum ili kalijum bromida sa fosfornom kiselinom ili razblaženom sumpornom kiselinom[12]:
- 2 KBr + H2SO4 → K2SO4 + HBr
Koncentrovana sumporna kiselina nije efektivna, zato što se formirani HBr oksiduje do gasovitog broma:
- 2 HBr + H2SO4 → Br2 + SO2 + 2H2O
Kiselina se takođe može pripremiti na nekoliko drugih načina, među kojima je reakcija broma sa bilo fosforom i vodom, ili sa sumporom i vodom[12]:
- 2 Br2 + S + 2 H2O → 4 HBr + SO2
Alternativno, ona se može pripremiti brominacijom tetralina (1,2,3,4-tetrahidronaftalena):[13]
- C10H12 + 4 Br2 → C10H8Br4 + 4 HBr
Brom se može redukovati fosfornom kiselinom:[7]
- Br2 + H3PO3 + H2O → H3PO4 + 2 HBr
Vodeni rastvor bromovodonika se se isto tako može pripremiti u malom obimu termolizom trifenolfosfonijum bromida u refluksujućem ksilenu.[6]
HBr pripremljen gore navedenim metodama može da bude kontaminiran sa Br2, koji se može ukloniti propuštanjem gasa kroz Cu opiljke ili kroz fenol.[11]
Референце
уреди- ^ „Hydrobromic Acid - Compound Summary”. PubChem Compound. USA: National Center for Biotechnology Information. 16. 9. 2004. Identification and Related Records. Приступљено 10. 11. 2011.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ^ а б Hercouet, A.;LeCorre, M. (1988) Triphenylphosphonium bromide: A convenient and quantitative source of gaseous hydrogen bromide. Synthesis, 157-158.
- ^ а б в Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford, Great Britain; 1997;, pp. 809-812.
- ^ Carlin, William W. U.S. Patent 4.147.601, April 3, 1979
- ^ Vollhardt, K. P. C.; Schore, N. E. Organic Chemistry: Structure and Function; 4th Ed.; W. H. Freeman and Company: New York, NY; 2003.
- ^ Hydrogen-based utility energy storage system
- ^ а б Ruhoff, J. R.; Burnett, R. E.; Reid, E. E. "Hydrogen Bromide (Anhydrous)" Organic Syntheses, Vol. 15, pp. 35 (Coll. Vol. 2, pp. 338).
- ^ а б Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill. 2002. ISBN 978-0-07-049439-8.
- ^ WebElements: Hydrogen Bromide