Birčova redukcija
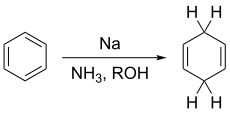
Birčova redukcija je organska reakcija koja se koristi za pretvaranje arena u 1,4-cikloheksadiene. Reakcija je nazvana po australijskom hemičaru Arturu Birču i uključuje organsku redukciju aromatičnih prstenova u aminskom rastvaraču (tradicionalno tečni amonijak) sa alkalnim metalom (tradicionalno natrijum) i izvorom protona (tradicionalno alkoholom). Za razliku od katalitičke hidrogenacije, Birčova redukcija ne redukuje aromatični prsten sve do cikloheksana.
Primer je redukcija naftalena u amonijaku i etanolu:
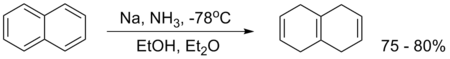
Mehanizam reakcije i regioselektivnost
уредиRastvor natrijuma u tečnom amonijaku sastoji se od intenzivno plave soli elektrida [Na(NH3)x]+ e−. Solvatirani elektroni se dodaju u aromatični prsten dajući radikalni anjon, koji zatim apstrahuje proton iz alkohola. Proces se zatim ponavlja na orto ili para poziciji (u zavisnosti od supstituenata) da bi se dobio konačni dien.[1] Preostale dvostruke veze ne stabilizuju dalje radikalne dodatke.[2][3]
Poznato je da je reakcija trećeg reda – prvog reda u aromatiku, prvog reda u alkalnim metalima i prvog reda u alkoholu.[4] Ovo zahteva da korak koji ograničava brzinu bude konverzija anjona radikala B u cikloheksadienil radikal C.
Taj korak takođe određuje strukturu proizvoda. Iako je Artur Birč prvobitno tvrdio da se protonacija dogodila na meta poziciji.[5] Naknadno istraživanje je otkrilo da se protonacija dešava ili na orto ili para poziciji. Donori elektrona imaju tendenciju da indukuju orto protonaciju, kao što je prikazano u redukciji anizola (1). Supstituenti koji povlače elektrone imaju tendenciju da indukuju para protonaciju, kao što je prikazano u redukciji benzojeve kiseline (2).[6]
Solvatirani elektroni će prvenstveno redukovati dovoljno elektronegativne funkcionalne grupe, kao što su ketoni ili nitro grupe, ali ne napadaju alkohole, karboksilne kiseline ili etre.[6]
Reference
уреди- ^ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd изд.), New York: Wiley, ISBN 0-471-85472-7
- ^ Rabideau, P. W.; Marcinow, Z. (1992). „The Birch Reduction of Aromatic Compounds”. Org. React. (review). 42: 1—334. ISBN 0471264180. doi:10.1002/0471264180.or042.01.
- ^ Mander, L. N. (1991). „Partial Reduction of Aromatic Rings by Dissolving Metals and by Other Methods”. Compr. Org. Synth. (review). 8: 489—521. ISBN 978-0-08-052349-1. doi:10.1016/B978-0-08-052349-1.00237-7.
- ^ Krapcho, A. P.; Bothner-By, A. A. (1959). „Kinetics of the Metal-Ammonia-Alcohol Reductions of Benzene and Substituted Benzenes1”. J. Am. Chem. Soc. 81 (14): 3658—3666. doi:10.1021/ja01523a042.
- ^ Birch 1944.
- ^ а б Carey, Francis A.; Sundberg, Richard J. (2007). Advanced Organic Chemistry. B: Reactions and Synthesis (5th изд.). New York: Springer. стр. 437—439. ISBN 978-0-387-44899-2.