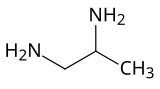
1,2-Diaminopropan
1,2-Diaminopropan (1,2-propandiamin) je diamin, koji je u širokoj upotrebi kao bidentatni ligand u koordinacionoj hemiji. On je najjednostavniji hiralni diamin. 1,2-Diaminopropan je bezbojna tečnost na sobnoj temperaturi.
| |
| Nazivi | |
|---|---|
| Preferisani IUPAC naziv
1,2-Propandiamin | |
| Sistemski IUPAC naziv
Propan-1,2-diamin | |
| Identifikacija | |
3D model (Jmol)
|
|
| Bajlštajn | 605274 |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.001.051 |
| EC broj | 201-155-9 |
| Gmelin Referenca | 25709 |
| MeSH | 1,2-diaminopropane |
| RTECS | TX6650000 |
| UN broj | 2258 |
| |
| Svojstva | |
| C3H10N2 | |
| Molarna masa | 74,13 g·mol−1 |
| Agregatno stanje | bezbojna tečnost |
| Miris | Poput mirisa ribe, amonijačni |
| Gustina | 870 mg mL−1 |
| Tačka topljenja | 2.090 °C; 3.790 °F; 2.360 K |
| Tačka ključanja | 3.654 °C; 6.609 °F; 3.927 K |
| Napon pare | 1,9 Pa (na 20 °C) |
| Indeks refrakcije (nD) | 1,446 |
| Termohemija | |
| Specifični toplotni kapacitet, C | 205,64 J K−1 mol−1 |
| Standardna molarna entropija S |
247,27 J K−1 mol−1 |
Std entalpija
formiranja (ΔfH⦵298) |
−98,2–−97,4 kJ mol−1 |
| Std entalpija sagorevanja ΔcH |
−2,5122–−2,5116 MJ mol−1 |
| Opasnosti | |
| GHS grafikoni |   
|
| GHS signalna reč | Opasnost |
| H226, H302, H312, H314 | |
| P280, P305+351+338, P310 | |
EU klasifikacija (DSD)
|
|
| R-oznake | R10, R21/22, R35 |
| S-oznake | S26, S37/39, S45 |
| Tačka paljenja | 34 °C (93 °F; 307 K) |
| 360 °C (680 °F; 633 K) | |
| Eksplozivni limiti | 1.9–11.1% |
| Letalna doza ili koncentracija (LD, LC): | |
LD50 (LD50)
|
|
| Srodna jedinjenja | |
Srodne alkanaminske materije
|
|
Srodna jedinjenja
|
2-Metil-2-nitrozopropan |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Priprema
уредиOvo jedinjenje se industrijski sintetiše putem amonolize 1,2-dihloropropana:[3] Ovaj postupak omogućava upotrebu otpadnih hloro-organskih jedinjenja za formiranje korisnih amina koristeći amonijak:[3]
- CH3CHClCH2Cl + 4 NH3 → CH3CH(NH2)CH2NH2 + 2 NH4Cl
Racemska smeša ovog hiralnog jedinjenja se može razdvojiti u enantiomere putem konverzije u dijastereoizomernu amonijum so tartarne kiseline. Nakon prečišćavanja dijastereoizomera, diamin se može regenerisati tretiranjem amonijum soli sa natrijum hidroksidom.[4] Alternativni reagensi za hiralnu rezoluciju obuhvataju N-p-toluensulfonilaspartinsku kiselinu, N-benzensulfonilaspartinsku kiselinu, ili N-benzoilglutaminsku kiselinu.[5]
Upotreba
уреди1,2-Diaminopropan se može konvertovati u N,N′-disaliciliden-1,2-propandiamin, korisni ligand salenskog tipa. To se može ostvariti putem reakcije kondenzacije diamina sa salicilaldehidom:[6]
- 2C6H4(OH)CHO + CH3CH(NH2)CH2NH2 → [C6H4(OH)CH]2CH3CHNCH2N + 2H2O
Reference
уреди- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Bartkowiak, M.; Lewandowski, G.; Milchert, E.; Pelech, R. (2006). „Optimization of 1,2-Diaminopropane Preparation by the Ammonolysis of Waste 1,2-Dichloropropane”. Ind. Eng. Chem. Res. 45: 5681—5687. doi:10.1021/ie051134u.
- ^ Romanowski, G.; Wera, M. (2010). „Mononuclear and dinuclear chiral vanadium(V) complexes with tridentate Schiff bases derived from R(-)-1,2-diaminopropane: Synthesis, structure, characterization and catalytic properties”. Polyhedron. 29: 2747—2754. doi:10.1016/j.poly.2010.06.030.
- ^ JP application 04-018057, Sakie, N. & Haruyo, S., "Production of Optically Active 1,2-propanediamine"
- ^ Dabelstein, W. (2005). „Automotive Fuels”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.