Нитрозил-хлорид
Нитрозил-хлорид је хемијско неорганско једињење хемијске формуле ClNO.
| |
| |
| Називи | |
|---|---|
| IUPAC назив
Нитрозил-хлорид
| |
| Други називи
Нитроген-оксихлорид
Нитрозонијум-хлорид | |
| Идентификација | |
| ECHA InfoCard | 100.018.430 |
| Е-бројеви | E919 (glazing agents, ...) |
| MeSH | Nitrosyl+chloride |
| RTECS | QZ7883000 |
| UN број | 1069 |
| Својства | |
| ClNO | |
| Моларна маса | 65,46 g/mol |
| Агрегатно стање | жути гас, црвена течност |
| Густина | 1,417 g/cm3 (течност, -12 °C) 2.99 g/L (гас) |
| Тачка топљења | -59.6 °C |
| Тачка кључања | -6.4 °C |
| разлаже се | |
| Растворљивост у хлорокарбону | растворљив |
| Структура | |
| Облик молекула (орбитале и хибридизација) | sp2 за N |
| Диполни момент | 1.90 D |
| Опасности | |
| Главне опасности | Веома отрован |
| NFPA 704 | |
| Сродна једињења | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Структура молекула
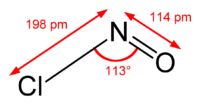
уредиИако се формула врло често пише NOCl, структура се боље приказује формулом ONCl. Између N и O постоји двострука веза (раздаљина = 1,16 Å), а између N и Cl постоји једнострука (раздаљина = 1,69 Å). Угао који заклапају O-N-Cl износи 113°.[1]
Добијање
уредиМоже се добити на више начина[2]:
1. реакцијом азот-моноксида и хлора на обичној температури, уз дрвени угаљ као катализатор:
2. реакцијом фосфор-пентахлорида и калијум-нитрита:
3. у царској води:
Физичка и хемијска својства
уредиТо је наранџастожут гас, који се претвара у црвенкасту течност на температури од -5,5 °C, а при -65 °C гради кристале лимун-жуте боје.[3][4] Реагује са водом градећи киселине:
Такође, реагује са живом градећи меркурохлорид и азот-моноксид, а гради и двогуба једињења као што је SnCl4•NOCl.[2]
Извори
уреди- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego. 2001. ISBN 978-0-12-352651-9..
- ^ а б Parkes, G.D. & Phil, D. 1973. Мелорова модерна неорганска хемија. Научна књига. Београд.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
