Еболавируси
Еболавируси су група вируса из рода еболавируса, који се налази унутар породице филовируса. Узрокује хеморагијску еболавирусну грозницу или класичну еболу, болест која спада у групу од четири вирусне хеморагијске грознице, која се карактерише следећим симптомима: болови мишића, изненадно повраћање, пораст телесне температуре, општа слабост, бол у грлу и главобоље. Није пронађена одговарајућа терапија за успешно лечење, а вакцина за превенцију болести је у завршној фази истраживања.[1]
| Еболавируси | |
|---|---|
| |
| Класификација вируса | |
| Group: | Група V ((−)ssRNA)
|
| Ред: | |
| Породица: | |
| Род: | |
| Врста: | |
Болест изазвана еболавирусом преноси се директним контактом са телесним течностима инфициране особе или преко животиња.
Еболавирусни геном састоји се од једноланчаних (негативних) РНК.
Назив
уредиВирус и болест коју он изазива добили су име по малој реци Ебола у Демократској Републици Конго (раније Заиру) која тече на западу ове земље, јер је са обала ове реке, северно од села Јамбуку, пореклом болесник од кога је добијен изолат вируса, који је и први пут препознат 1976. године у болници коју су водиле часне сестре фламанке.
Име вируса је касније измењено након проналаска различитих изолата вируса (нпр. заирски еболавирус, судански еболавирус, рестонски еболавирус).
Епидемиологија
уреди|
Епидемија еболе је више последица слабог здравственог система него било чега другог. Пол Фармер, стручњак за здравство и јавно здравље |
Епидемија изазвана вирусом Ебола јавила се у два наврата 1976. године, прво у Судану а затим у Демократској Републици Конго, други пут крајем августа 1976. године. Епидемија еболе у Демократској Републици Конго резултовала је смртношћу од скоро 90%. Укупно је у Заиру идентификовано 318 случајева еболе, а 280 је резултовало смрћу.[2][3]
Појава додатних 284 случаја од којих је умрло 151 болесника догодила се у близини Јужног Судана у неповезаној епидемији. Мисија болнице „Јамбуку” у истоименом селу затворена је након што је у њој умрло 11 од 17 чланова медицинског тима. Такође су заражене и белгијске монахиње који су служили заједници, а троје је умрло, након што је група болесника пребачена у Киншасу.
СЗО је, угрожен епидемиолошки рад екипа на терену помогла стерилизацијом медицинске опреме и пружањем заштитне одеће медицинском особљу. А мали Конгоански ваздухоплови ангажовани су за снабдевање тима и обилазак оболелих у 550 села у тој области.[2]
Резервоар и начини преноса вируса
уредиПриродни резервоар вируса није јасно доказан. Као један од могућих резервоар вируса Ебола сматрају се воћни слепи мишеви (или летипси), код којих су доказана еболавирусна РНК антитела, али нису дефинитивно потврђени као главни резервоари ЕБОВ[4] Иако је доказан пренос вируса са слепих мишева на људе,[5] још се са сигурношћу не може рећи који су главни резервоари и путеви преношења вируса.
Болест је утврђена и међу горилама,[6] али и међу свињама.
Интерхумани пренос вируса се углавном одвија преко контакта са крвљу и секретом (урин, пљувачка, столица, повраћани садржај) болесника и контактом са лешевима умрлих. Употреба сировог меса заражених животиња и контактом са лешинама заражених животиња такође се може пренети инфекција.[7][8]
Вирус се може задржати у ејакулату мушкараца и до три месеца, па се еболавирус може класификовати као изазивач полно преносиве болести.[9]
У епидемијама вирус се преноси са болесника директним контактом здраве особе са крвљу или другим телесним течностима заражених, како живих тако и преминулих. Вируси се не преносе ваздухом ни комарцима, а болесници постају заразни и почињу излучивати вирусе након појаве симптома.[10]
Еболавируси су осетљиви на уобичајене дезинфицијенсе (натријум хипоклорит, једињења фенола, метил алкохол, етар, 2% глутаралдехид, бета-пропиолактон, формалдехид) и детерџенте попут натријум-лаурилсулфат, а инактивирају се излагањем температури од 60 °C након 30 до 60 минута или прокувавањем у трајању од пет минута. Прживљавају врло кратко у спољној средини, посебно на површинама изложеним сунчевој светлости.[11]
Класификација
уредиУнутар породице филовируса постоје три рода: еболавируси, марбургвируси,[12][13] узрочник карантинске и високопатогене марбуршке хеморагијске грознице, и квевавируси са једном врстом за коју инфекција код људи није позната.[14][15]
Род еболавируса се дели на пет одвојених врста: заирски еболавирус, судански еболавирус, рестонски еболавирус, еболавирус шуме Таи и еболавирус Бундибуџо.
- Вирус Еболе (EBOV)
Прва врста која је откривена имала уједно највећу смртност је вирус Еболе. Смртност ове врсте вируса је у просеку око 83% у просеку у протеклих 27 година. Ова врста вируса је најчешће узрокована избијањем инфекције и његовом везом са другим вирусима.[16]
- Судански вирус (SUDV)
Друга врста вируса која се појавила у готово исто време као и вирус Еболе, код једног радника у фабрици дувана у граду Нзара, у Судану, који је могуће био изложен природном резервоару вируса. Научници су тестирали све животиње и инсекте на том подручју и нису нашли опрему. Ширење болести се наставило услед неадекватних хигијенско-епидемиолошких мера за заштиту медицинског особља. Последња епидемија је била у мају 2004. године са 20 потврђених случајева инфекције, од којих је 5 умрло.[17]
- Рестонски вирус (RESTV)
Ова врста откривена је током епидемије хеморагичне грознице код макаки мајмуна који се хране раковима 1989. године у америчком граду Рестону. Ова врста није патогена за људе, иако је болест пријављена на Филипинима, Италији и Тексасу.
- Еболавирус шуме Таи (TAFV)
Ова врста вируса откривена је међу мајмунима у шумама Обале Слоноваче. Једна од научница која је радила некропсије тела мртвих мајмуна развила је симптоме денге (вирусна болест чији тежи облици могу бити слични хеморагијској грозници). Током 6 недеља, потпуно је поправио.
- Вирус Бундибуџо (BDBV)
У новембру 2007. потврђено је избијање еболе у округу Бундибуџо у Уганди, а касније је утврђено да се ради о новој врсти вируса. Према званичном извештају владе Уганде током епидемије, било је око 149 оболелих са укупно 37 смртних случајева.[18]
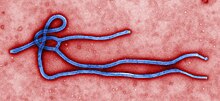
Структура
уредиЕлектронска микрографија еболавируса показује да он има филаментну структуру карактеристичну за филовирусе (Filoviridae). Вирион је цилиндрично/тубуларног изгледа са омотачем вируса, нуклеокапсидом, који носи негативни РНК геном. Цилиндри су у пречнику око 80 nm, и опасани су вирусно кодираним гликопротеином (ГП) који се пројектује формирање спикуле 7-10 nm у дужини од површине липидног двослоја. Цилиндри су променљиве дужине, обично 800 nm, али понекад достижу и 1.000 nm.
Спољни вирусни омотач вирион изведен је из одвојене плазма мембране ћелије домаћина на подручјима где су делови ГП убачени током своје биосинтезе. Сваки ГП молекул је одвојен од следећих око10 nm. ВП40 и ВП24 вирусни протеини налазе се између омотача и нуклеокапсида у простору поља.[19]
Централну структуру вириона чини нуклеокапсид, који се састоји од вирусних протеина везаних за РНК негативну линеарну 18-19 кб полиаденилациону 3 'или 5' кеп структуру; РНК је обавијена спирално и комплексом беланчевина НП, ВП35, ВП30 и Л.[20] Хеликс је пречника 80 nm и садржи централни канал пречника 20-30 nm.
Геномска структура еболавируса
уредиДок се у ћелијским организмима налазе увек обе врсте нуклеинских киселина ДНК и РНК, код вируса долази само једна од њих. Нуклеинске киселине су саставни део вирусних партикула, а различити вируси садрже у честици различите износе нуклеинских киселина. Вируси нуклеинске киселине представљају геном вируса. Геном је скуп гена организма садржаног у хаплоидном хромозомском сету. За разлику од целуларних организама, код вируса и РНК може бити носилац генетичке информације, па се разликују РНК-вируси и ДНА-вируси.[21]
Овај вирусни геном кодира седам структурних протеина и један неструктурни протеин, који носе важне сигнале за контролу транскрипције, репликације и паковања вирусних геномова у нове вирионе. Секције НП, ВП35 и Л гена из филовируса идентификоване су као ендогене у геномима неколико група малих сисара.[22][23][24]
Имунопатогенеза
уредиЦиљно место инфекције су ендотелне ћелије, макрофаге и дендритичне ћелије. Након инфекције у зараженим ћелија прво се синтетизује вирусно сегрегирани гликопротеин (скраћено sGP). Заражени леукоцити такође служе као носиоци вируса, које транспортује кроз тело у регионалне лимфне чворове где се настављају репликације вируса, а затим слободни вируси и инфицирани моноцити преко лимфне микроциркулације улазе у крвоток и инфестирају макрофаге и дендритичне ћелије у слезини, јетри, лимфним чворовима и другим органима.[25] Унутар солидних органа вирус инфицира и паренхиматозне ћелије при чему долази до некрозе и карактеристичне ликвефакције органа.
Еболавирус потом репликацијом синтетизује протеине у инфицираним ћелијама имунолошке одбране домаћина. Гликопротеин вируса, А гликопротеин, формира трансмитер, којом допрема вирус до ендотелијалних ћелија које покривају унутрашњу површину крвних судова.
Такође гликопротеин (скраћено ГП) формира димер који омета сигнализацију неутрофила (врсте белих крвних зрнаца у крви ), што омогућава вирусу да избегне инхибиторно деловање имуног система, инхибицијом ране фазе активације неутрофила. Заражени леукоцити такође служе као носиоци вируса, које транспортује кроз тело у органе као што су лимфни чворови, јетра, плућа и слезина.[25]
Ендотелне ћелије су инфициране тек у каснијој фази инфекције и заједно са макрофагама, производе велике количине проинфламаторних интерлеукина IL-1β и IL-6, факторе некрозе тумора TNF-α, типа I, али и IL-10, који инхибира имунски одговор и индукује апоптозу лимфоцити Т. Т лимфоцити су отпорни на еболавирусну инфекцију, али подлежу значајној апоптози која резултује лимфопенијом, која се у смртоносним облицима инфекције назва „имунска парализа”.
Цитопатски ефекат инфекције ендотелијалних ћелија, потом доводе до губитка васкуларног интегритета синтезом ГП, што смањује интегрин и специфичне интегрине одговоре ћелијских адхезионих интрацелуларних структура и оштећења јетре, а то може изазвати коагулопатију (која може бити праћена хеморагијским манифестацијама, којима се карактеришу многе, али не и све инфекције еболом).[26]
Инфекције филовирусима такође ометају правилно функционисање урођеног имуносистема.[27] Протеински еболавируси разоружају део одговора људског имуносистема тако што вирусне инфекције ометају способност ћелија да произведу и реагују на интерферон као што су интерферон алфа, бета и гама.[28][29] Ова интерференција се одвија кроз структурне протеине ВП24 и ВП35 еболавируса.
Када је ћелија инфицирана еболавирусом, рецептори у цитосолу ћелије (као што риг-И и МДА5 ) или ван цитосола (као што су Толични рецептори 3, 7, 8 и 9), који препознају инфективне молекуле повезане са вирусом.[28] Када се ови рецептори активирају, протеини као регулатор фактор интерферона 3 и регулаторног фактор интерферона 7 иницирају сигналну каскаду која доводи до експресије интерферона тип 1.[28] Тип 1 интерферон се онда ослобађа и везују за рецепторе IFNAR1 и IFNAR2 експримиране на површини суседних ћелија.[28]
Када се интерферон придружио својим пријемницима на суседним ћелијама, активирају се сигнални протеини STAT1 и STAT2 који прелазе у једро ћелије.[28] Они активира експресију гена које стимулишу интерферон, и који кодирају протеине који имају антивирусна својства.[28] Протеин на V24 еболавирусе онемогућава протеину STAT1 сигнализацију између суседних ћелија у једру и тиме спречава стварање антивирусних протеина.[28] Други протеин еболавируса који се зове V35 директно инхибира производњу интерферона-бета.[29]
За разлику од лимфоцита Т, током еболавирусне инфекција не долази до значајне апоптозе лимфоцита Б, али ове ћелије не учествују у контроли акутне инфекције. Међутим, присуство антитела специфичних за вирусе неопходно је да контролише ширење вируса у каснијој фази, и највероватније, за резолуцију инфекције.[30][31]
Извори
уреди- ^ Kuhn, Jens H.; Becker, Stephan; Ebihara, Hideki; Geisbert, Thomas W.; Johnson, Karl M.; Kawaoka, Yoshihiro; Lipkin, W. Ian; Negredo, Ana I.; Netesov, Sergey V.; Nichol, Stuart T.; Palacios, Gustavo; Peters, Clarence J.; Tenorio, Antonio; Volchkov, Viktor E.; Jahrling, Peter B. (2010). „Proposal for a revised taxonomy of the family Filoviridae: Classification, names of taxa and viruses, and virus abbreviations”. Archives of Virology. 155 (12): 2083—103. PMID 21046175. S2CID 13788197. doi:10.1007/s00705-010-0814-x..
- ^ а б Garrett, Laurie (1994). The Coming Plague: Newly Emerging Diseases in a World of out Balance. London: Virago Press. стр. 100–105. ISBN 978-1-86049-211-2.
- ^ Johnson, K. M.; Lange, J. V.; Webb, P. A.; Murphy, F. A. (1977). „Isolation and partial characterisation of a new virus causing acute haemorrhagic fever in Zaire”. Lancet. 309 (8011): 569—571. PMID 65661. S2CID 19368457. doi:10.1016/S0140-6736(77)92000-1..
- ^ Brook, C. E.; Dobson, A. P. (2015). „Bats as 'special' reservoirs for emerging zoonotic pathogens”. Trends Microbiol. 23 (3): 172—80. PMC 7126622 . PMID 25572882. doi:10.1016/j.tim.2014.12.004..
- ^ Rewar, S.; Mirdha, D. (2014). „Transmission of ebola virus disease: an over- view”. Ann Glob Health. 80 (6): 444—51. PMID 25960093. doi:10.1016/j.aogh.2015.02.005..
- ^ Genton, C.; Pierre, A.; Cristescu, R.; Lévréro, F.; Gatti, S.; Pierre, J. S.; Ménard, N.; Le Gouar, P. (2015). „How Ebola impacts social dynamics in gorillas: a multistate modellingapproach”. J Anim Ecol. 84 (1): 166—76. PMID 24995485. doi:10.1111/1365-2656.12268..
- ^ Goeijenbier, M.; Van Kampen, J. J.; Reusken, C. B.; Koopmans, M. P.; Van Gorp, E. C. (2014). „Ebolavirus disease: a review on epidemiology, symptoms,treatment and pathogenesis”. Neth J Med. 72 (9): 442—8. PMID 25387613.
- ^ Rewar, S.; Mirdha, D. (2014). „Transmission of ebola virus disease: an overview”. Ann Glob Health. 80 (6): 444—51. PMID 25960093. doi:10.1016/j.aogh.2015.02.005..
- ^ Rogstad, K. E.; Tunbridge, A. (2015). „Ebola virus as a sexually transmitted infection”. CurrOpin Infect Dis. 28 (1): 83—5. PMID 25501666. S2CID 7538665. doi:10.1097/QCO.0000000000000135..
- ^ Kuhn JH. Filoviruses—a compendium of 40 years of epidemiological, clinical, and laboratory studies. Vol. 20. Springer; Wien: 2008. Archives of virology supplement.
- ^ Vanessa, Nraabe; Matthias, Borchert (2012). „Infection control during filoviral hemorrhagic Feveroutbreaks”. J Glob Infect Dis. 4 (1): 69—74. PMID 22529631. doi:10.4103/0974-777X.93765 ..
- ^ Towner, J. S.; Khristova, M. L.; Sealy, T. K.; Vincent, M. J.; Erickson, B. R.; Bawiec, D. A.; Hartman, A. L.; Comer, J. A.; Zaki, S. R.; Ströher, U.; Gomes Da Silva, F.; Del Castillo, F.; Rollin, P. E.; Ksiazek, T. G.; Nichol, S. T. (2006). „Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola”. J Virol. 80 (13): 6497—6516. PMC 1488971 . PMID 16775337. doi:10.1128/JVI.00069-06.
- ^ Valmas C, Grosch MN, Schumann M, Olejnik J, Martinez O, Best SM, Krahling V, Basler CF, Muhlberger E. Marburg virus evades interferon responses by a mechanism distinct from Ebola virus. PLoS Pathog. 2010;6:e1000721.
- ^ Feldmann H, Geisbert TW, Jahrling PB, Klenk H-D, Netesov SV, Peters CJ, Sanchez A, Swanepoel R, Volchkov VE. Family Filoviridae. In: Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA, editors. Virus taxonomy—eighth report of the International Committee on Taxonomy of Viruses. Elsevier/Academic Press; San Diego, California, USA: 2005. pp. 645–653
- ^ „Viral haemorrhagic fever in southern Sudan and northern Zaire, Preliminary studies on the aetiological agent”. Lancet. 309: 571—573. 1977. PMID 65662. S2CID 3092094. doi:10.1016/S0140-6736(77)92001-3..
- ^ Kuhn, Jens H.; Jahrling, Peter B. (2010). „Clarification and guidance on the proper usage of virus and virus species names”. Arch Virol. 155 (4): 445—453. PMC 2878132 . PMID 20204430. doi:10.1007/s00705-010-0600-9..
- ^ Valmas C, Grosch MN, Schumann M, Olejnik J, Martinez O, Best SM, Krahling V, Basler CF, Muhlberger E. Marburg virus evades interferon responses by a mechanism distinct from Ebola virus. PLoS Pathog. 2010;6:e1000721.
- ^ Towner JS, Sealy TK, Khristova ML, Albariño CG, Conlan S, Reeder SA, Quan PL, Lipkin WI, Downing R, Tappero JW, Okware S, Lutwama J, Bakamutumaho B, Kayiwa J, Comer JA, Rollin PE, Ksiazek TG, Nichol ST. Newly discovered Ebola virus associated with hemorrhagic fever outbreak in Uganda. PLoS Pathog. 2008;4:e1000212.
- ^ Feldmann, H. K. (1993). "Molecular biology and evolution of filoviruses". Archives of virology. Supplementum 7: 81–100. ISSN 0939-1983
- ^ Biomarker Database. Ebola virus. Korea National Institute of Health. Consultado o 2009-05-31.
- ^ McCormick JB. Family Filoviridae. In: Francki RIB, Fauquet CM, Knudson DL, Brown F, editors. Classification and nomenclature of viruses—fifth report of the International Committee on Taxonomy of Viruses. Vol. 2. Springer; Vienna, Austria. 1991. стр. 247–249.. Archives of virology supplement.
- ^ Taylor, D.; Leach, R.; Bruenn, J. (2010). „Filoviruses are ancient and integrated into mammalian genomes”. BMC Evolutionary Biology. 10: 193. PMC 2906475 . PMID 20569424. doi:10.1186/1471-2148-10-193 .
- ^ Belyi, V. A.; Levine, A. J.; Skalka, A. M. (2010). Buchmeier, Michael J., ур. „Unexpected Inheritance: Multiple Integrations of Ancient Bornavirus and Ebolavirus/Marburgvirus Sequences in Vertebrate Genomes”. PLOS Pathogens. 6 (7): e1001030. PMC 2912400 . PMID 20686665. doi:10.1371/journal.ppat.1001030 .
- ^ Taylor, D. J.; Ballinger, M. J.; Zhan, J. J.; Hanzly, L. E.; Bruenn, J. A. (2014). „Evidence that ebolaviruses and cuevaviruses have been diverging from marburgviruses since the Miocene”. PeerJ. 2: e556. PMC 4157239 . PMID 25237605. doi:10.7717/peerj.556 .
- ^ а б Smith, Tara . Ebola (Deadly Diseases and Epidemics). Ebola. Chelsea House Publications. 2005. ISBN 978-0-7910-8505-9.
- ^ Sullivan, N.; Yang, Z. Y.; Nabel, G. J. (2003). „Ebola virus pathogenesis: Implications for vaccines and therapies”. Journal of Virology. 77 (18): 9733—9737. PMC 224575 . PMID 12941881. doi:10.1128/jvi.77.18.9733-9737.2003.
- ^ Olejnik, Judith; Ryabchikova, Elena; Corley, Ronald B.; Mühlberger, Elke (2011). „Intracellular Events and Cell Fate in Filovirus Infection”. Viruses. 3 (8): 1501—1531. PMC 3172725 . PMID 21927676. doi:10.3390/v3081501 .
- ^ а б в г д ђ е Kühl A, Pöhlmann S (setembro 2012). ""How Ebola virus counters the interferon system"". Zoonoses Public Health 59 (Suplemento 2): 116–31.
- ^ а б Ramanan, Parameshwaran; Shabman, Reed S.; Brown, Craig S.; Amarasinghe, Gaya K.; Basler, Christopher F.; Leung, Daisy W. (2011). „Filoviral Immune Evasion Mechanisms”. Viruses. 3 (9): 1634—1649. PMC 3187693 . PMID 21994800. doi:10.3390/v3091634 .
- ^ Wauquier N, Becquart P, Padilla C, Baize S, Leroy EM. Human fatalzaire ebola virus infection is associated with an aberrant innateimmunity and with massivelymphocyte apoptosis. PLoS NeglTrop Dis. 2010; 4(10).
- ^ Wolf K, Beimforde N, Falzarano D, Feldmann H, Schnittler HJ.The Ebola virussoluble glycoprotein (sGP) does not affect lymphocyteapoptosis and adhesion toactivated endothelium. The Journal of Infectious Diseases. 2011; 204 Suppl 3: S947–52.
Спољашње везе
уреди- Дилеме око назива — еболавирус или ебола вирус? (језик: енглески)
| Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |