Azot trioksid
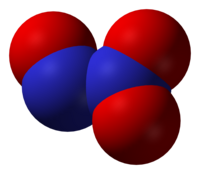
Azot trioksid (diazot trioksid) je hemijsko jedinjenje sa formulom N2O3. Ova duboko plava tečnost je jedan od binarnih azotnih oksida. On se formira nakon mešanja jednakih delova azot monoksida i azot dioksida i hlađenjem smeše ispod −21 °C (−6 °F):[3]
| |
| |
| Nazivi | |
|---|---|
| Drugi nazivi
Azotni anhidrid
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.031.013 |
| |
| Svojstva | |
| N2O3 | |
| Molarna masa | 76,01 g/mol |
| Agregatno stanje | plava tečnost |
| Gustina | 1,4 g/cm3, tečnost 1.783 g/cm3 (gas) |
| Tačka topljenja | −100.1°C (173.05 K) |
| Tačka ključanja | 3°C (276 K) |
| veoma rastvoran | |
| Struktura | |
| Oblik molekula (orbitale i hibridizacija) | planaran, Cs |
| Termohemija | |
| Standardna molarna entropija S |
314.63 J K−1 mol−1 |
Std entalpija
formiranja (ΔfH⦵298) |
+91.20 kJ/mol |
| Opasnosti | |
EU klasifikacija (DSD)
|
Visoko toksičan (T+) |
| NFPA 704 | |
| Tačka paljenja | Nije zapaljiv |
| Srodna jedinjenja | |
| Azot suboksid Azot monoksid Azot dioksid Azot tetroksid Azot pentoksid | |
Srodna jedinjenja
|
Azotna kiselina |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
- NO + NO2 ⇌ N2O3
Azot trioksid je nerastvoran samo na niskim temperaturama, i.e. u tečnoj i čvrstoj fazi. Na višim temperaturama ravnoteža ze povoljna za sastavne gasove, sa Kdiss = 193 kPa (25 °C).[4]
Struktura i vezivanje
urediTipično su N–N veze slične dužine sa vezama hidrazina (145 pm). Azot trioksid, međutim, ima neobično dugačku N–N vezu sa 186 pm. Neki drugi oksidi azota takođe poseduju duge N–N veze, npr. diazot tetroksid (175 pm). N2O3 molekul je planaran i ispoljava Cs simetriju. Dimenzije prikazane ispod su dobijene mikrotalasnom spektroskopijom na niskoj temperaturi za gasoviti N2O3[3]:
On je anhidrid nestabilne azotaste kiseline (HNO2), koji prelazi u azotastu kiselinu kad se pomeša sa vodom. Alternativna struktura bi bila struktura anhidrida, i.e. O=N–O–N=O, međutim ovaj izomer nije nađen. Ako se azotasta kiselina ne potroši brzo, on se razlaže u azot monoksid i azotnu kiselinu. Azotne soli se mogu formirati dodavanjem N2O3 u rastvore baza:
- N2O3 + 2 NaOH → 2 NaNO2 + H2O
Reference
uredi- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Greenwood, Norman N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford: Pergamon. стр. 521—22. ISBN 0-08-022057-6. doi:10.1002/crat.2170200510.
- ^ Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
