Amonijum sulfat
Amonijum sulfat ((NH4)2SO4) je neorganska so sa brojnim komercijalnim primenama. Najčešća upotreba je u đubrivu.[5][6][7] On sadrži 21% azota u obliku amonijum katjona, i 24% sumpora u obliku sulfatnih anjona. U đubrivu, namena sulfata je redukcija pH zemljišta.[8]
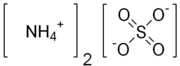
| |
| |
| Nazivi | |
|---|---|
| IUPAC naziv
Ammonium tetraoxosulfate (VI)
| |
| Drugi nazivi
Amonijum sulfat
Amonijum sulfat (2:1) Diamonijum sulfat Diamonijum so sumporne kiseline Maskagnit Aktamaster Dolamin | |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.076 |
| EC broj | 231-984-1 |
| E-brojevi | E517 (regulator kiselosti, ...) |
| KEGG[1] | |
| UNII | |
| |
| Svojstva | |
| (NH4)2SO4 | |
| Molarna masa | 132,14 g/mol |
| Agregatno stanje | Fino bele higroskopne granule ili kristali. |
| Gustina | 1,77 g/cm3 |
| Tačka topljenja | 235 °C (455 °F; 508 K) (razlaže se) |
| 70,6 g na 100 g vode (0 °C) 74,4 g na 100 g vode (20 °C) 103,8 g na 100 g vode (100 °C)[4] | |
| Rastvorljivost | Nerastvoran u acetonu, alkoholu i etru |
| -67,0·10−6 cm³/mol | |
| 79,2% (30 °C) | |
| Opasnosti | |
| GHS grafikoni |  
|
| GHS signalna reč | Upozorenje |
| H315, H319, H335 | |
| P261, P264, P270, P271, P273, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313 | |
| NFPA 704 | |
| Tačka paljenja | Nije zapaljiv |
| Letalna doza ili koncentracija (LD, LC): | |
LD50 (LD50)
|
2840 mg/kg, pacov (oralno) |
| Srodna jedinjenja | |
Drugi anjoni
|
Amonijum tiosulfat Amonijum sulfit Amonijum bisulfat Amonijum persulfat |
Drugi katjoni
|
Natrijum sulfat Kalijum sulfat |
Srodna jedinjenja
|
Amonijum gvožđe(II) sulfat |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Upotreba
urediOn se uglavnom koristi kao veštačko đubrivo za alkalna zemljišta. U zemljištu se amonijum joni oslobađaju i formiraju male količine kiseline, snižavajući pH balans zemljišta, istovremeno dajući azot koji je esencijalan za rast biljaka. Glavni nedostatak upotrebe amonijum sulfata je njegov niski sadržaj azota u odnosu na amonijum nitrat, čime se povećavaju troškovi transporta.[9] On se takođe koristi kao pomoćno sredstvo u poljoprivrednim sprejevima za u vodi rastvorne insekticide, herbicide, i fungicide. Njegova ulaga je vezivanje katjona gvožđa i kalcijuma koji su prisutni u bunarskoj vodi, kao i u ćelijama biljaka. On je posebno efektivan kao dodatak za 2,4-D (amin), glifosat, i glufosinatne herbicide. On se takođe koristi u pripremi drugih amonijum soli. U biohemiji, amonijum sulfatna precipitacija je uobičajeni metod za prečišćavanje proteina putem selektivne precipitacije. Amonijum sulfat je izuzetno rastvoran u vodi tako da može da formira izuzetno koncentrovane rastvore koji mogu da se koriste za isoljavanje proteina. Ovo je podesan i jednostavan način frakcionisanja kompleksnih proteinskih smeša.[10] Kao takav, amonijum sulfat se takođe navodi kao sastojak mnogih vakcina.[11] Amonijum sulfat se koristi kao prehrambeni aditiv. Zasićeni rastvor amonijum sulfata u teškoj vodi (2H2O) se koristi kao spoljašnji standard u sumpornoj (33S) NMR spektroskopiji sa vrednošću pomeraja od 0 ppm.
Laboratorijska upotreba
urediAmonijum sulfatna precipitacija je često korišteni metod za proteinsko prečišćavanje putem precipitacije. Sa povećanjem jonske jačine rastvora, smanjuje se rastvorljivost proteina u rastvoru. Amonijum sulfat je ekstremno rastvoran u vodi usled njegove jonske prirode, stoga on može da „isoli” proteine putem precipitacije.[12] Usled visoke dielektrične konstante vode, disocirani joni soli, katjonski amonijum i anjonski sulfat, lako bivaju solvatirani unutar hidratacionih ljuski molekula vode. Značaj ove supstance u prečišćavanju jedinjenja proističe iz njene sposobnosti da postane u većoj meri hidratisana u odnosu na relativno nepolarne molekule, te se usled toga željeni nepolarni molekuli spajaju i talože iz rastvora u koncentrovanom obliku. Ovaj metod se naziva isoljavanje. Pri njegovoj primeni neophodne su visoke koncentracije soli koja se pouzdano rastvara u vodenim smešama. Procenat soli predstavlja odnos korištene i maksimalne koncentracije soli koja se može rastvoriti u rastvoru. Stoga, iako su neophodne visoke koncentracije da bi metod funkcionisao, dodavanje velikih količina soli, preko 100%, može da prezasiti rastvor, te da kontaminira nepolarni precipitat sa precipitatom soli.[13] Visoke koncentracije soli, koje se mogu ostvariti dodavanjem ili povećavanjem koncentracije amonijum sulfata u rastvoru, omogućavaju razdvajanje na bazi umanjene rastvorljivosti proteina; ova separacija se može ostvariti centrifugiranjem. Precipitacija amonijum sulfatom je rezultat redukovanja rastvorljivosti, a ne proteinske denaturacije, stoga se istaloženi protein može rastvoriti putem upotrebe standardnih pufera.[14] Amonijum sulfatna precipitacija pruža prikladan i jednostavan način za frakcionisanje kompleksnih mešavina proteina.[15]
U analizi gumenih rešetki, isparljive masne kiseline se analiziraju precipitacijom gume sa 35% rastvorom amonijum sulfata, koji ostavlja bistru tečnost iz koje se isparljive masne kiseline regenerišu sumpornom kiselinom i zatim destilišu sa parom. Selektivno taloženje sa amonijum sulfatom, suprotno uobičajenoj tehnici taloženja koja koristi sirćetnu kiselinu, ne ometa određivanje isparljivih masnih kiselina.[16]
Prehrambeni aditiv
urediKao prehrambeni aditiv, amonijum sulfat se generalno smatra bezbednim, što je u skladu da stavom američke Uprave za hranu i lekove,[17] i Evropske unije, gde se označava E brojem E517. On se koristi kao regulator kiselosti u brašnu i hlebu.[18][19][20]
Druge upotrebe
urediAmonijum sulfat se koristi u malim količinama u pripremi drugih amonijum soli, a posebno amonijum persulfata.
Amonijum sulfat je sastojak mnogih vakcina u Sjedinjenim Državama prema podacima Centra za kontrolu bolesti.[21]
Zasićeni rastvor amonijum sulfata u teškoj vodi (D2O) se koristi kao spoljašnji standard u sumpornoj (33S) NMR spektroskopiji sa vrednošću pomeraja od 0 ppm.
Amonijum sulfat je isto tako korišten u formulacijama supresora plamena pri čemu deluje na sličan način kao diamonijum fosfat.[22] Kao supresor plamena, on povećava temperaturu sagorevanja materijala, umanjuje maksimalne stope gubitka težine, i uzrokuje porast produkcije ostataka ili čađi.[23] Njegova efikasnost kao supresor plamena se može povećavati mešanjem sa amonijum sulfamatom. On je korišten za vazdušno gašenje požara.
Amonijum sulfat je korišćen kao konzervans za drvo, ali zbog njegove higroskopne prirode, ova upotreba je u velikoj meri obustavljena zbog problema sa korozijom metalnih pričvršćivača, dimenzionalnom nestabilnošću i problema pri završnoj obradi.
Priprema
urediAmonijum sulfat se pravi tretiranjem amonijaka, čestog nusprodukta iz koksanih peći, sumpornom kiselinom:
- 2 NH3 + H2SO4 → (NH4)2SO4
Smeša amonijačnog gasa i vodene pare se uvodi u reaktor koji sadrži zasićeni rastvor amonijum sulfata i oko 2 do 4% slobodne sumporne kiseline na 60 °C. Koncentrovana sumporna kiselina se dodaje da bi se održala kiselost rastvora, i zadržao njen nivo u obliku slobodne kiseline. Toplota reakcije održava temperaturu reaktora na 60 °C. Suvi amonijum sulfat u prahu se može formirati prskanjem sumporne kiseline u reakcionu komoru ispunjenu amonijačnim gasom. Toplota reakcije dovodi do isparanja sve vode prisutne u sistemu, te se formira praškasta so. Približno 6000M tona je bilo proizvedeno 1981. godine.[9]
Amonijum sulfat se takođe proizvodi iz gipsa (CaSO4·2H2O). Fino samleveni gips se dodaje u rastvor amonijum karbonata. Kalcijum karbonat se taloži kao čvrta materija, ostavljajući amonijum sulfat u rastvoru.
- (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
Amonijum sulfat se prirodno javlja kao retki mineral maskagnit u vulkanskim fumarolama i usled sagorevanja koksa na nekim deponijama.[24]
Osobine
urediAmonijum sulfat postaje feroelektričan na temperaturama ispod -49,5 °C. Na sobnoj temperaturi se kristalizuje u ortorombičnom formatu, sa ćelijama veličine a = 7,729 Å, b = 10,560 Å, c = 5,951 Å. Kad se ohladi do ferorelektričnog stanja, simetrija kristala se menja do prostorne grupe Pna21.[25]
Reference
uredi- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ „Fritz Haber”. Science History Institute (на језику: енглески). 2016-06-01. Приступљено 2022-12-16.
- ^ „Total fertilizer production by nutrient”. Our World in Data. Архивирано из оригинала 12. 06. 2022. г. Приступљено 7. 3. 2020.
- ^ Uekötter, Frank (2014). „Why Panaceas Work: Recasting Science, Knowledge, and Fertilizer Interests in German Agriculture”. Agricultural History. 88 (1): 68—86. ISSN 0002-1482. JSTOR 10.3098/ah.2014.88.1.68. doi:10.3098/ah.2014.88.1.68.
- ^ Properties: UNIDO and International Fertilizer Development Center . Fertilizer Manual. Kluwer Academic Publishers. 1998. ISBN 978-0-7923-5032-3.
- ^ а б Karl-Heinz Zapp (2012). „Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry”. Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243.
- ^ Protocol and on-line calculator for use of ammonium sulphate to fractionate proteins from
- ^ Appendix B: Vaccine Excipient & Media Summary, Part 2
- ^ Duong-Ly & Gabelli 2014, стр. 85–94
- ^ Duong-Ly, Krisna C.; Gabelli, Sandra B. (1. 1. 2014). „Salting out of proteins using ammonium sulfate precipitation”. Methods in Enzymology. 541: 85—94. ISBN 9780124201194. ISSN 1557-7988. PMID 24674064. doi:10.1016/B978-0-12-420119-4.00007-0.
- ^ Wingfield, Paul T. (5. 5. 2017). „Protein Precipitation Using Ammonium Sulfate”. Current Protocols in Protein Science. 13 (1): A.3F.1—8. ISBN 978-0471140863. ISSN 1934-3655. PMC 4817497 . PMID 18429073. doi:10.1002/0471140864.psa03fs13.
- ^ „Ammonium Sulfate Calculator”. EnCor Biotechnology Inc. 2013. Приступљено 2. 3. 2013.
- ^ ASTM Standard Specification for Rubber Concentrates D 1076-06
- ^ „Select Committee on GRAS Substances (SCOGS) Opinion: Ammonium sulfate”. U.S. Food and Drug Administration. 16. 8. 2011. Приступљено 2. 3. 2013.
- ^ „Panera Bread › Menu & Nutrition › Nutrition Information Profile”. Архивирано из оригинала 19. 8. 2009. г. Приступљено 2. 3. 2013.
- ^ „Official Subway Restaurants U.S. Products Ingredients Guide”. Архивирано из оригинала 14. 8. 2011. г. Приступљено 2. 3. 2013.
- ^ Klein, Sarah (14. 5. 2012). „Gross Ingredients In Processed Foods”. The Huffington Post. Приступљено 2. 3. 2013.
- ^ „Vaccine Excipient & Media Summary” (PDF). Centers for Disease Control and Prevention (CDC). februar 2012. Приступљено 2. 3. 2013.
- ^ John R Van Wazer (1958). Phosphorus And Its Compounds - Volume I: Chemistry. New York: Interscience Publishers, Inc. стр. 503.
- ^ George, C. W.; Susott, R. A. (april 1971). „Effects of Ammonium Phosphate and Sulfate on the Pyrolysis and Combustion of Cellulose”. Research Paper INT-90. Intermountain Forest and Range Experiment Station: USDA Forest Service.
- ^ „Mascagnite”. Mindat. Приступљено 2. 3. 2013.
- ^ Okaya, Y.; Vedam, K.; Pepinsky, R. (1958). „Non-isomorphism of ferroelectric phases of ammonium sulfate and ammonium fluoberyllate”. Acta Crystallographica. 11 (4): 307. ISSN 0365-110X. doi:10.1107/s0365110x58000803.
Literatura
uredi- Properties: UNIDO and International Fertilizer Development Center . Fertilizer Manual. Kluwer Academic Publishers. 1998. ISBN 978-0-7923-5032-3..
- Uekötter, Frank (2010). Die Wahrheit ist auf dem Feld: Eine Wissensgeschichte der deutschen Landwirtschaft. Vandenhoeck & Ruprecht. ISBN 978-3-5253-1705-1.
- Mbow, C.; Rosenzweig, C.; Barioni, L. G.; Benton, T.; et al. (2019). „Chapter 5: Food Security” (PDF). Climate Change and Land: an IPCC special report on climate change, desertification, land degradation, sustainable land management, food security, and greenhouse gas fluxes in terrestrial ecosystems. стр. 454.
- McKetta Jr, John J., ур. (1990). Encyclopedia of Chemical Processing and Design (Chemical Processing and Design Encyclopedia). New York: Marcel Dekker, Inc. стр. 478,520. ISBN 978-0-8247-2485-6.
- John R Van Wazer (1958). Phosphorus And Its Compounds - Volume I: Chemistry. New York: Interscience Publishers, Inc. стр. 503.
Spoljašnje veze
uredi- Amonijum sulfat u bazi podataka o svojstvima pesticida (PPDB)
- Calculators: surface tensions Архивирано на сајту Wayback Machine (22. фебруар 2020), and densities, molarities and molalities Архивирано на сајту Wayback Machine (22. фебруар 2020) of aqueous ammonium sulfate
- Nitrogen for Feeding Our Food, Its Earthly Origin, Haber Process Архивирано на сајту Wayback Machine (11. јануар 2017)
- International Fertilizer Industry Association (IFA)
- Agriculture Guide, Complete Guide to Fertilizers and Fertilization (archived 6 October 2011)
- Nitrogen-Phosphorus-Potassium Values of Organic Fertilizers. Архивирано 26 фебруар 2021 на сајту Wayback Machine.
